分享:增材制造可降解金属医用植入物
1.
2.
3.
4.
5.
增材制造技术由于其高精度、高自由度等特点,可赋予医用金属植入物定制化的宏观与微观结构,使植入物与患者待修复缺损部位实现更好的生物力学适配,满足临床治疗个性化方案的需求,并为医用金属植入物的制造提供新途径。可降解金属目前是医用金属的研究热点,增材制造可降解金属医用植入物是个新方向,本文重点对增材制造镁基、锌基、铁基可降解金属的工艺流程及影响因素、力学性能、降解行为、生物相容性相关结果进行分析与总结,并展望了增材制造技术在医用可降解金属植入物领域的未来发展方向。
关键词:
金属材料具有优异的综合力学性能(高强韧性、耐疲劳)和良好的加工成形能力,医用金属植入物在骨科、口腔、心血管等领域得到了广泛的临床应用。传统制造工艺基于模具和减材制造,难以获得复杂的几何形状,无法适应精准医疗的个性化需求,限制了其更广泛应用。增材制造(additive manufacturing,AM),即3D打印,是一类通过三维计算机辅助设计(CAD)数据将材料按照顺序逐层构建为物体的制造技术,为获取个性化的复杂三维结构提供了可靠途径,可高效可靠地复制与组织和器官相关的解剖形态[1]。与传统制造技术相比,增材制造技术在个性化定制方面表现出独特优势。目前,包括纯Ti及钛合金[2~5]、不锈钢[6]、钴基合金[7,8]等传统生物惰性医用金属材料的增材制造已经得到了临床应用。进入21世纪以来,增材制造医用金属及植入物成为生物制造领域的研究热点,同时,可降解金属也成为医用金属材料领域新的增长点,本文聚焦医用可降解金属增材制造的研究现状,总结现有成果并展望其未来的发展趋势与方向。
目前临床使用的医用金属材料多为传统惰性材料,包括纯Ti及钛合金、不锈钢、钴基合金等,其植入人体后将作为异物在患者体内长期存在,或服役结束后需经二次手术取出。此外,这些材料在磨损或腐蚀的过程中可能释放有害离子、金属盐或磨损颗粒,引起过敏反应、炎症反应等[9~11]。21世纪以来,可降解金属逐渐成为医用金属材料的研究热点。作者团队[12]于2014年给出了可降解金属的第一版定义及分类,2019年将定义更新为:可降解金属是一类可以在体内逐渐腐蚀,释放出的腐蚀产物引起适当的宿主反应,这些腐蚀产物可以通过细胞和/或组织,或被细胞和/或组织代谢或同化,并在完成协助组织愈合的任务后完全消失无残留[13]。可降解金属主要包括镁基(Mg)可降解金属、锌基(Zn)可降解金属、铁基(Fe)可降解金属3个体系,3类可降解金属的性能总结如表1[12~17]所示。镁基可降解金属的力学性能与人体骨骼最相近,Mg是维持人体健康必须的营养元素之一,Mg参与与人体的能量代谢、蛋白质和DNA合成以及维持线粒体膜稳定相关的600多种酶反应[18],且镁离子在促进骨组织愈合过程中发挥积极作用[19]。Zn的标准电极电位为-0.763 V (vs SHE),介于Mg的标准电极电位-2.37 V (vs SHE)与Fe的标准电极电位-0.44 V (vs SHE)之间,降解速率介于Mg和Fe之间,且降解过程中不释放氢气。可降解锌合金较可降解镁合金的力学性能更佳[13],但锌离子对于不同细胞的安全阈值要比镁离子低100~500倍,人体中85%的Zn存在于肌肉和骨骼中,11%的Zn存在于皮肤和肝脏。Fe及其合金在可降解金属体系中有最优异的力学性能,可与传统的医用金属材料相当[12],元素Fe主要存在于血液环境中,研究表明,成人体内Fe的总量约为4~5 g,其中72%以血红蛋白、3%以肌红蛋白、0.2%以其他化合物形式存在,因此往往被用来制备心血管支架。传统医用金属材料与可降解金属的特点对比及应用总结如表2[20,21]所示。
Table 1
IC50 oascular endothelial cells /
(mmol·L-1)
Table 2
通过增材制造方法开发制造出精准的植入器械,是目前的研究趋势。2012年发布的ASTM F2792-12a标准将增材制造技术分为7大类:光聚合成形(vat polymerization)、材料喷射成形(material jetting)、材料挤出成形(material extrusion)、粉床熔融成形(powder bed fusion,PBF)、黏结剂喷射成形(binder jetting)、层压成形(sheet lamination)、直接能量沉积成形(direct energy deposition,DED),如表3[22]所示。其中,DED和PBF技术是2种主要的金属部件增材制造的工艺[23]。DED技术通常被用于生产大型粗糙形状构件,而PBF技术被认为更适合制造复杂的多孔结构植入物[23]。相较于DED技术,PBF技术有着更小的束斑直径、更细的粉末、更薄的成形层[24],因此,PBF较DED有更高的尺寸精度(PBF:0.04~0.2 mm,DED:0.5~1.0 mm)[23]与更广泛的商业化;相比于黏结剂喷射成形技术,PBF技术无需使用黏结剂以及进行打印后的烧结步骤,这使得PBF技术优于黏结剂喷射成形技术[22,24]。
表3 不同3D打印方法总结[22]
Table 3
PBF技术是通过刮刀在基板上铺一层金属粉末,然后使用激光或电子束按照计算机设定的程序有选择地熔融或烧结所需的区域,这一过程反复进行,降低基板,在前一层上铺上另一层金属粉末,并选择性地熔融或烧结这一层和下面的一层。与传统的制造工艺相比,PBF技术成形试样具有以下特点:① 成形过程中的蒸发所导致的试样成分变化;② 较快的冷却速率,减少了成分偏析和第二相析出,细化了晶粒,形成了非平衡组织;③ 较大的温度梯度使得晶粒取向生长,晶粒呈现择优分布,形成了织构[25]。在PBF中,粉末层是通过激光(L-PBF)或电子束(EB-PBF)等能量源进行热熔融的。EB-PBF技术与L-PBF技术2者相比,L-PBF技术有着更小的激光光斑、加热更精确、冷却更快、粉体材料更细小(L-PBF:10~60 μm,EB-PBF:60~105 μm[23])、成形精度高,设备价格及维护成本低廉,且在成形过程中不像EB-PBF技术需要真空环境,而是通过充入惰性气体进行保护[23,26]。目前,PBF技术在医用金属领域的应用主要集中在不可降解金属领域,如纯Ti[27]、钛合金[28]、不锈钢[29]、Ta[30]、钴铬合金[8]、镍钛合金[31]等,其中,部分PBF技术制备的不可降解金属植入物已经取得了成功的临床应用。对于PBF技术在可降解金属领域的应用,值得注意的是,EB-PBF过程的粉体材料被高能电子束融化时产生大量烟尘,污染了成形腔内的真空环境,故不适合用于可降解金属的加工[25],目前采用PBF技术成形可降解金属的研究基本都采用L-PBF技术。未来L-PBF可降解金属领域的挑战在于:① 成形过程的安全性。由于Zn、Mg等可降解金属相较于传统生物惰性金属有着较低的熔点和较高的化学活性,在成形过程易燃易爆。② 良好成形质量的获得。不同成分的粉体材料以及个性化成形的支架几何结构对PBF工艺及设备提出了新的要求,同时粉体材料应具有良好稳定的成形质量,这是获得良好PBF成形质量的基础。
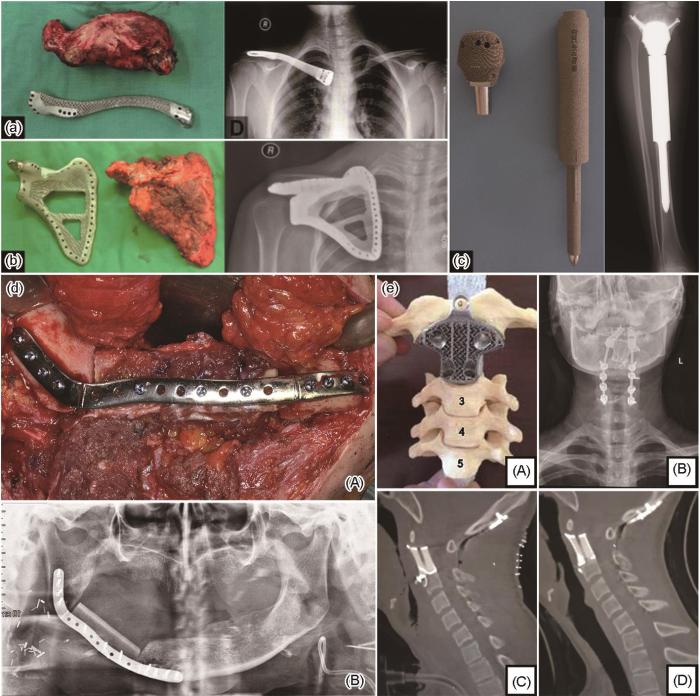
Ti及钛合金具有机械强度高、耐腐蚀、生物相容性高等优点,临床应用广泛[32],也是目前增材制造技术中应用最广泛的金属材料,被用来制备个性化髋臼杯、椎间融合器、锁骨、肩胛骨、胫骨假体及牙科种植体等,如图1a~c[33~35]所示。
图1 为患者量身定制的AM植入物(用于重建切除的骨肿瘤)具体实例及X光照片:包括锁骨、肩胛骨、胫骨近端非骨水泥重建[33~35],3D打印下颌骨钛合金接骨板(术中及术后12个月)[3],及3D打印钛合金定制人工椎体移植手术(模型上演示手术过程,术后X射线演示如何将自稳定的人工椎体插入缺失处,术后即刻进行矢状面重建,及术后1年后随访影像学显示骨结合良好,植入物未移位或下沉,肿瘤无局部复发)[4]
(a-c) clavicle (a), scapula (b), and uncemented proximal tibial reconstruction (c), respectively [33-35]
(d) additively manufactured Ti alloy bone plate[3]
(A) reconstruction of unilateral mandible with AM Ti bone plate
(B) 12 months postoperative radiologic examination
(e) replacement using AM Ti alloy vertebral body[4]
(A) model
(B) postoperative X-ray demonstrating how the self-stabilizing artificial vertebral body was inserted C2
(C) sagittal reconstruction immediately postoperatively
(D) at the 1-year follow-up showing evidence of implant osseointegration, no subsidence or displacement of the construct, and no local recurrence of the tumor
Fig.1 Examples of AM patient specific implants used for reconstruction of resected bone tumours and follow-up X-ray films showing placement, specifically
(1) 骨植入物
Winder等[2]于1999年制备了用于修复颅骨缺损的AM颅骨钛板,该植入物在贴合性和美观性都较传统医用金属植入物有较大改进。2012年,Ciocca等[3]在利用AM技术完成了对颌面部肿瘤切除造成的下颌骨间断缺损的二次重建修复(图1d[3])。与传统的下颌骨二次重建修复相比,使用AM钛合金支架可以大大缩短重建手术时间(术中时间减少1.5 h),且能最大程度地恢复患者原始的颌面部轮廓,使植入物与剩余的下颌支有较好的连续性。在术后平均12个月的影像学随访期间也未观察到并发症。2016年,美国食品药品监督管理局(FDA)批准了3D打印的个性化颅骨钛板植入物的临床应用。
2007年,首个EB-PBF工艺3D打印的钛合金髋臼杯Delta-TT被植入患者[36],至今全球植入PBF工艺制备的髋臼杯病例已超过10万例[25]。如今已有多种商业化大规模生产的AM钛合金植入物通过了美国FDA批准认证,如4-Web Medical Inc.生产的Ti-6Al-4V合金截骨术桁架、Smith & Nephew公司生产的Ti-6Al-4V合金髋臼杯元件[37]。王姗姗等[38]对54例患者根据术后Harris评分、UCLA评分和临床疗效判定3D打印组患者的术后评分和临床疗效均优于骨水泥组。目前,已有较多3D打印钛合金人工髋关节置换术的应用病例[5,39,40]。叶堃等[41]对1例右髂骨巨大软骨肉瘤患者实施了右侧半骨盆切除置换术,并植入个性化钛合金骨盆假体,术后3个月患者可逐渐独立行走,术后6个月随访显示植入物骨结合稳定,患者活动无明显不适。人工椎体方面,Xu等[4]根据计算机模型设计制造的钛合金人工椎体用以替代缺失的C2椎骨(图1e[4]),患者术后恢复良好,回归正常生活。此外,AM脊柱植入手术个性化导板也有着较好的应用效果。宁金沛等[42]通过3D打印的个性化导板为7例需要行胸椎、颈椎椎弓根螺钉植入术的患者辅助手术,成功植入23枚螺钉,仅1枚穿破椎弓根外壁但穿出距离均小于1.2 mm,植入准确率96%,所有病例均未出现神经、血管损伤等并发症。
(2) 牙科医疗器械
制备符合患者拔牙窝形态的个性化钛合金种植体有助于提高牙科种植体的临床效果。Mangano等[43]分析患者锥形束CT影像资料中需拔除牙根的形态设计,通过选择性激光熔融制备了定制化TC4种植体,在拔除牙根后即刻植入AM钛合金牙种植体,种植体与拔牙窝实现了良好骨结合,1年后随访显示种植体稳定,证实L-PBF技术可成功应用于口腔种植领域。此外,利用AM个性化种植基台来塑造牙龈轮廓形态也有重要临床意义[44]。
刘一帆等[45]比较了AM与传统失蜡法铸造所得可摘局部义齿支架,结果表明,AM可摘局部义齿支架的精度与加工效率更高,降低了传统失蜡铸造法对技师的技术要求,同时减少了传统方法步骤繁琐所导致的加工误差。通过口内扫描和L-PBF技术,Hu等[46]制作出定制化可摘局部义齿钛支架,缩短了治疗时间,提高了义齿使用舒适度。
钴基合金具有优异的机械强度、耐腐蚀性和生物相容性,同时其制造成本相对较低,在临床应用多年[47,48],产品涉及人工关节假体可摘局部义齿、全口义齿支架、烤瓷冠基底等。目前,AM钴铬合金烤瓷冠是非贵金属烤瓷熔附金属冠的首选,AM钴铬合金可摘局部义齿已被广泛应用[7,8]。口腔内pH未进食时平均为5.0,进食后可低至< 3.0,这种特殊的环境需要口腔内的金属材料具备更高的抗腐蚀性,避免材料腐蚀后析出致敏、具有细胞毒性的金属离子。实验[49]表明,在pH = 2.5及pH = 5.0环境下,L-PBF钴铬合金的电耐蚀性优于传统铸造工艺钴铬合金。
以316L不锈钢为代表的医用不锈钢材料具有良好的耐腐蚀性、较低的价格,是最早应用于生物医学领域的金属材料之一,在骨科、牙科等领域广泛应用。孔卫东等[6]使用气雾化-500目316L球形不锈钢粉末,通过L-PBF技术逐层熔化、堆积出个性化舌侧托槽,提高了效率同时减少了工作流程过长的误差;与设计图及传统舌侧托槽对比,显示贴合度佳、不易脱落等优点。
2.1.4 钽 Ta金属因其良好的生物相容性、高耐腐蚀性、低弹性模量、剪切力和摩擦系数高、优异的骨整合特性等特点作为植入体材料被广泛研究[50~52]。1997年,多孔钽获得FDA批准用作人工髋臼的临床治疗[53],至2016年全球标准多孔钽植入物已经累计有超100万例临床应用[54],但这些钽植入体多采用气相沉积方法制备。近年来,3D打印多孔钽医用植入物成为研究热点。2010年,Balla等[55]通过激光近净成形技术(laser engineered net shaping,LENS)技术制造了多孔钽样品,其相对密度在45%~73%,结果表明AM多孔钽较AM多孔钛合金的细胞黏附与增殖能力提升,显示其在促成骨方面有良好应用前景。2015年,Wauthle等[30]通过L-PBF技术制备了孔隙率为80%、平均支架杆直径为150 μm、平均孔径为500 μm的十二面体结构的多孔钽植入物,结果表明其具有良好的生物相容性与促成骨能力。
目前,增材制造多孔钽的研究处于起步阶段,粉体材料制备及专用设备是限制目前规模化开展个性化多孔钽植入体的主要问题[54],但L-PBF等增材制造技术由于其高自由度、高效率的特点,有望成为未来制造个性化多孔钽植入物的重要方式。
2.2.1 可降解金属增材制造的工艺影响因素与传统惰性金属材料相比,可降解金属尤其是锌合金和镁合金的熔点低、沸点低及化学活性较高,给可降解金属的增材制造过程的安全性及试样成形质量带来挑战[56]。
金属粉体的质量显著影响增材制造成形构件的最终质量,粉体应满足颗粒纯净度高、致密度高、较窄的粒径分布区间、球形度高、无气孔夹杂等缺陷、具有良好的流动性和可塑性等要求[57]。制备金属粉体的方法有气体雾化(GA)、水雾化(WA)、旋转雾化(RA)、等离子体旋转电极(PREP)等。图2a[58]为GA法制得的JDBM镁合金的粉末,粒径介于50~75 μm范围内,大部分粉体材料表面光滑,具有较好的球形度。图2b[59]为N2雾化法制备的纯Zn粉末,粉体平均粒径为28.4 μm,粉体截面孔隙少。Mg很活跃,易于与氧进行反应,尤其是Mg粉体容易引起强烈的放热反应。通常建议在雾化过程中对Mg粉进行氧化钝化,以确保运输和操作过程中的安全,也有文献[60]报道通过合金化的方法加入Ca、Zn和Mn元素来降低Mg粉的氧化敏感性。然而,粉末中的氧对L-PBF工艺有负面影响。熔化氧化层需要更多的激光能量,因此熔池中的温度更高,这反过来又加剧了蒸发,在成形过程中易形成孔洞和夹杂物等缺陷[24]。Mg粉中合金元素的量也会影响PBF成形试样的最终质量,Wei等[61]关于L-PBF加工Mg-Zn二元合金的研究表明,Zn含量的增加对L-PBF加工的合金的致密化有明显破坏作用,当Zn含量超过1% (质量分数)时,沉积层产生凝固裂纹和微裂纹。粉末粒度也会影响成形试样的质量,Hu等[62]关于L-PBF成形纯Mg的研究指出,平均粒径为43 μm的Mg粉末的相对密度为96.13%,平均粒径为26 μm的Mg粉末的相对密度为95.28%。在相同能量输入的情况下,细粉体的熔池温度更高,导致严重的氧化及球化现象。2017年,Demir等[63]发现,Zn粉末直径15 μm组成形的块体试样较9 μm组成形的块体更致密。
图2 气体雾化法制造的JDBM (Mg-Nd-Zn-Zr合金)粉末[58]和N2雾化法制造的纯Zn粉末[59]的SEM像
Fig.2 SEM images of JDBM (Mg-Nd-Zn-Zr alloy) powders fabricated by gas atomization (a)[58] and nitrogen atomized pure Zn powder (b)[59] (It is also observable that smaller particles are attached onto the surface of some powder particles (indicated by white arrows in Fig.2a), and that some powder particles have a partial shell (indicated by black arrows in Fig.2a))
在粉体材料中添加纳米颗粒的相关工作目前较少,Shuai等[64]通过L-PBF的方法制备了羟基磷灰石(HA)增强的Zn-Mg复合材料,结果表明,由于材料晶粒尺寸的减少和骨状磷灰石保护层的形成,成形试样在模拟体液(SBF)中的降解速率减慢。此外,晶粒尺寸随HA含量的增加而不断减小,这归因于异质性成核和凝固过程中成核颗粒数量的增加。同时,由于细晶强化作用以及第二相强化作用,材料的硬度不断增加。
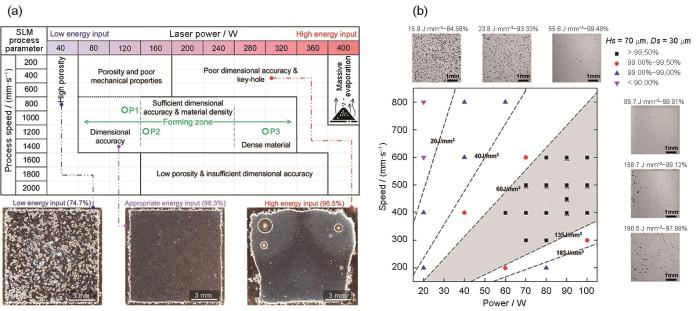
DebRoy等[23]指出,多个参数影响L-PBF技术的成形过程,其中,成形激光束的能量是最重要的参数。Karunakaran等[65]认为成形参数中激光功率和扫描速率对熔池、蒸发和沉积产生显著的影响。Esmaily等[66]认为L-PBF中缺陷的形成依赖于熔池的流动性,而这取决于2个成形参数:① 激光能量(高的激光能量可改善熔池润湿性,为粉体固结提供更多能量);② 扫描速率(低的扫描速率可增加激光与粉体相互作用时间)[67,68]。因为难以界定单一参数对于成形质量的最终影响,所以人们纳入一个等效指标:激光能量密度(Ev,J/mm3)来进行评估,如
L-PBF成形样品有2个重要指标:致密度以及表面粗糙度。通常认为,拥有良好致密度的样品亦有着良好的表面质量,反之亦然[24]。总的来说,成形材料的致密度是由激光和粉体材料的相互作用所造成的粉体熔化行为决定的。高能量密度导致粉末蒸发使得熔池内蒸气压的局部积累,压力使得熔池中的熔融物质向外飞溅,从而形成匙孔等缺陷,导致低密度的结构,且与原始粉末相比,这种粉末蒸发也导致了化学成分的变化,而低能量密度则会导致粉末熔融不足的情况[65]。值得注意的是,能量密度的具体值只有在特定情况下才有意义,因为不同的搭接距离、粉层厚度都会影响到能量密度,相同的能量密度并不一定能保证成形样品质量的稳定性[59],因此最佳的Ev值要视具体的粉体材料成分以及激光束扫描成形策略而确定。
图3a[66]为Esmaily等[66]的研究工作中得到的改变激光功率和扫描速率得到的WE43合金窗口图,图中有2个极端区域,即低能量输入和高能量输入区。当试样以低能量输入区的参数成形时,成形过程中大量存在的气孔和粉体未熔融,使其致密度低且力学强度较差;在高能量输入下,由于Mg的低沸点(1090℃)会发生蒸发现象,试样中出现匙孔,且尺寸精度差。在成形区,激光能量及扫描速率之间得到了平衡,获得了合适的熔池温度/润湿性,可以在保证成形试样的良好尺寸精度的同时,使试样拥有高达98.3%的致密度。图3b[59]为Wen等[59]的研究中得到的以不同激光功率及扫描速率成形纯Zn的成形窗口图,图3b[59]以Ev将成形窗口图划分为6个不同的区域,左上角的区域为能量密度最低的区域,低能量密度使得层间及熔道之间出现了熔融不足的缺陷,材料致密度最低。另一种极端情况是右下角的参数窗口,此窗口具有最高能量密度,熔池能量高,材料蒸发剧烈,产生大量Zn蒸气,降低了匙孔的稳定性,匙孔坍塌时,Zn蒸气被截留在熔池中,由此产生了分布随机、形状呈圆形的气孔,造成了材料的低致密度。在图3b[59]中高亮区域(Ev = 60~135 J/mm3)可以得到致密度超过99.5%的材料,在此参数窗口,所有粉末都被熔融,匙孔处于稳定状态,但不可避免地存在少量气孔。
图3 L-PBF成形WE43的激光功率-扫描速率窗口图[66],及不同激光功率、扫描速率下,纯Zn密度与能量密度的关系[59]
Fig.3 Power-speed process map for L-PBF prepared WE43 (a)[66] and relationship between density and Ev under different powers and speeds (b)[59] (Hs—hatch spacing, Ds—layer thickness, Ev—volume energy; SLM—selective laser melting)
在材料设备方面,因锌基、镁基可降解金属低沸点的特性,其在高能激光束的作用下会产生剧烈的蒸发反应与溅射,产生大量金属蒸气,阻碍激光束的传播,导致激光束散射,影响最终成形质量,为此需要对设备增添辅助的气体循环系统,去除成形过程中产生的金属蒸气,并且引入实时原位监测熔池和粉床的现场的手段[69],通过深度学习卷积神经网络算法等机器学习方法针对原位的图像进行处理,识别缺陷的产生,并实时改善设备的工艺参数可能是一种未来途径。成形过程基础理论的研究,如热源的性质、热源与粉体材料的相互作用、传热传质和熔池流动原理、温度分布及冷却速率等[23,70]。
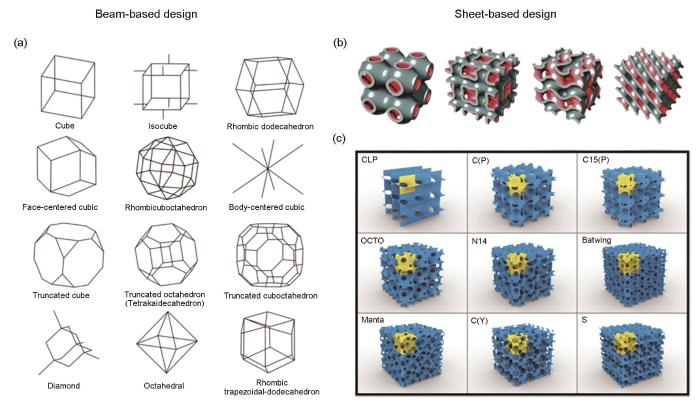
在AM多孔生物材料的结构设计中,单元体结构通常可以分为基于梁的设计和基于片的设计[71]。常见单元体结构总结如图4[28,71]所示。进一步,基于梁的设计单元体结构可分为弯曲主导结构和拉伸主导结构,通常弯曲主导结构具有较高的能量吸收能力,而拉伸主导结构具有较高的刚度和屈服强度[56,71,72]。与基于梁的设计相比,基于片的设计的一个优点是它们通常具有更好的力学性能[28,73]。
(a) beam-based designs[71]
(b) topological design based on four different types of triply periodic minimal surfaces (TPMS)[28]
(c) a catalogue of different types of minimal surfaces[71]
Fig.4 The summary of additively manufactured porous biomaterials' lattice structures
AM可降解金属多孔材料的力学性能、降解性能、生物相容性等都与其几何结构(孔隙率、单元体结构等)密切相关。现有的AM可降解金属研究所选用的单元体主要有钻石型、螺旋二十四面体结构、骨仿生结构等。Lietaert等[74]研究了钻石、十二面体、八隅体、三维Kogome (笼目)等5种不同单元体结构的增材制造多孔锌合金的力学性能,在30%的相对密度下,Kogome单胞的支架表现出最优异的屈服强度,而八隅体单胞的支架强度最低(与理论相反),这是由八隅体单胞的支架较差的成形质量所致,其水平支架杆表面有较多颗粒附着,且有浮渣形成。Li等关于多孔镁[75]、多孔锌[76]、多孔铁[77]的腐蚀疲劳行为的研究工作表明几何结构会影响增材制造的可降解金属植入物的疲劳行为,如对于金刚石结构单胞的多孔支架,在压缩时,其疲劳裂纹易于在拉应力集中的支架杆连接处形核[56]。
Li等关于多孔镁[78]、多孔锌[79]、多孔铁[80]的体外降解行为的研究表明,AM多孔可降解金属材料的腐蚀行为表现出强烈的位置相关性。在修正的模拟体液(r-SBF)中浸泡28 d后,具有钻石单胞的AM多孔WE43镁合金支架中心的降解相较于支架边缘更显著。而在相同浸泡条件下,具有钻石单胞的AM多孔铁支架边缘较支架中心表现出更显著的降解行为。
由于可降解金属植入体内后不断降解,多孔支架的各项性质都呈现时间相关性,结构设计变得更为复杂,还需进一步探究多孔支架几何结构与力学性能、生物学功能、降解行为之间的联系;探究降解行为对材料力学完整性、细胞生长等的影响。通过功能梯度的设计,实现对支架不同部位综合性能的调控与平衡以适应临床的具体需求会是未来的一个研究方向[81,82]。拓扑优化[83,84]及计算机数字建模的方法是优化传统惰性金属植入物设计的一类有效途径[85~88]。由于AM可降解金属的各项性能互相关联,每项性能由多因素影响及控制,通过传统的方法难以量化其中的联系,未来通过神经网络、逻辑斯蒂回归等传统机器学习算法去建立模型尝试量化之间的联系[89]。
样品的表面粗糙度影响植入体的力学性能、降解速率[90,91]以及植入体与机体间的生物学相互作用。增材制造成形后的样品表面大多沾有粉末颗粒,这会增加细菌定植的风险[92],对样品的生物相容性产生不利影响。对于多孔结构的可降解金属支架而言,常用的喷砂处理、化学侵蚀等手段无法在支架内外获得均匀平滑的表面[75,77],这种不均匀性可能导致支架不同部位的降解差异性,支架过早丧失力学完整性。此外,喷砂处理造成材料表面的残余应力层也可能会影响材料的降解行为。
涂层已被广泛应用于调控块体可降解金属的降解行为以及其生物学功能[93~96]。目前只有少数关于涂层改善AM可降解金属多孔材料的研究。Wang等[58]对螺旋二十四面体结构单元的JDBM多孔支架进行了二水合磷酸氢钙(DCPD)的表面涂层处理,结果表明DCPD处理极大地减缓了支架的降解速率,且提高了支架的生物相容性。Kopp等[97]利用等离子体电解氧化(PEO)手段对L-PBF技术制备的不同孔径WE43镁合金支架进行成形后表面处理,实验结果表明PEO显著降低了支架在DMEM浸泡初期的降解速率,浸泡21 d后,PEO改性表面的稳定性降低,薄弱区域受到侵蚀并产生了裂纹。Yang等[98]通过水热法在3D打印多孔铁支架上制备了可调节的纳米HA涂层,结果表明HA涂层对铁离子释放的抑制作用使支架的细胞相容性显著增加,且可促进兔骨髓间充质干细胞的成骨向分化。如何均匀地改善多孔AM可降解金属的表面性质还需要进行更多探索。
热处理以及热等静压(hot isostatic pressing,HIP)等方法也被用来改善增材制造金属样品的性能。HIP已被用来改善AM多孔Ti-6Al-4V的疲劳强度与疲劳极限[99,100]。Esmaily等[66]对L-PBF成形的WE43镁合金的研究发现,HIP处理(520℃,103 MPa,4 h)是消除工艺缺陷的有效方法,从而获得几乎全致密的试样。Gangireddy等[101]的研究表明,在较高的初始孔隙率下,HIP处理有利于L-PBF成形WE43镁合金的致密化,但由于孔隙的封闭性质,无法改善较小孔隙率样品的致密度。成形过程中,L-PBF的冷速为105~106 K/s,而传统的铸造方法冷速为1~102 K/s,L-PBF过快的冷速可能不利于强化相的析出,可通过热处理来消除过快冷速[102]造成的大量残余应力、沿热流方向产生的织构及力学各向异性[103]。HIP技术在改善AM可降解金属多孔材料的疲劳性能方面将有一定意义。
近几年来,传统工艺制备的可降解金属植入物已经获得了不同国家的认证。① 镁基可降解金属。2013年,德国Syntellix公司开发的Mg-Y-RE-Zr合金空心加压骨螺钉Magnezix®获得欧盟CE产品认证[104]。2015年,韩国U&I公司研发Mg-Zn-Ca合金螺钉K-MET取得韩国药监局(KFDA)认证,用于手掌骨骨折的固定[104,105]。2020年,中国东莞宜安科技公司研发的可降解纯Mg骨钉获得欧盟CE认证。2014年,美国Transluminal Technologies公司研发的velox CD可吸收镁合金血管闭合装置获得CE认证,用于经皮股动脉切开手术后血管闭合。2016年,德国Biotronik公司研发的镁合金冠状动脉内支架Magmaris®获得欧盟CE产品认证[106]。2021年,爱尔兰Q3 Medical Devices Limited公司宣布QualiMed的球囊可扩张生物降解胆道支架UNITY-B(MgNdMn21)获得CE认证。2021年,德国Biotiss公司开发的口腔全降解高纯Mg材料及口腔镁膜,获得CE认证。② 铁基可降解金属。中国先健科技/元心科技有3个铁基心血管支架产品开始了临床植入[107,108]:2018年,IBS铁基冠脉支架和IBS Angel铁基肺血管支架开始FIM临床试验;2020年,IBS Titan铁基外周支架开始临床试验并在中美欧进行临床植入;2021年,IBS Angel铁基肺血管支架获批马来西亚注册证和美国FDA同意使用。③ 锌基可降解金属。2020年,空军军医大学口腔医院完成了国际首例可降解锌合金(湖南华耀百奥医疗)颌面骨折内固定手术。
增材制造可降解金属植入物的研发也在迅速发展,总结如图5a[59,69,77,78,80,81,109~121]所示,已通过L-PBF技术成功制备了镁基、锌基、铁基可降解金属骨组织工程支架及血管支架样品[59,113,118](图5b[113]、5c[59]和5d[118])。下文以时间顺序,分别介绍增材制造镁基、锌基、铁基可降解金属领域的重要工作。
图5 可降解金属增材制造的发展历程及研究(L-PBF技术制备的可降解金属支架及血管支架)[59,69,77,78,80,81,109~121],镁基可降解金属[113],锌基可降解金属[59],及铁基可降解金属[118]
Fig.5 Timelines displaying a historical background of AM biodegradable metals research and development, biodegradable scaffolds and stents made by L-PBF (L-PBF—laser powder bed fusion) (a)[59,69,77,78,80,81,109-121], Mg-based biodegradable metals (b)[113], Zn-based biodegradable metals (c)[59], and Fe-based biodegradable metals (d)[118]
可降解镁合金的增材制造过程中主要存在2个主要问题[24],一是安全防护问题,由于Mg的高活性,使得Mg粉在打印过程中易燃易爆[78];二是打印过程中严重的蒸发问题,Mg的饱和蒸气压高,被激光束融化时会发生剧烈的蒸发现象,导致成形样品化学成分的变化,以及形成匙孔等缺陷。
2010年,Ng等[109]采用脉冲Nd:YAG激光器在保护气氛下进行纯Mg粉末的单道熔覆,证明了L-PBF工艺在镁支架的制备中具有潜力。2012年,Zhang等[110]用L-PBF方法打印Mg-9%Al的粉末混合物(纯Mg粉末与纯Al粉末),结果表明,当激光能量密度由7.5 J/mm3提升至15 J/mm3时,试样孔隙率由25.5%降低至18%,而当激光能量密度继续升高,由15 J/mm3提升至20 J/mm3,试样孔隙率则表现出升高的趋势。此外,他们还发现,Mg与成形舱内气体相互作用会引起氧化。2015年,Jauer等[113]首次采用L-PBF技术制备了AZ91镁合金多孔支架,如图5b[113]所示,证实了利用AM技术制造复杂形状的多孔可降解镁合金植入物是可行的。2017年,Jauer等[114]根据CT扫描的患者下颌形状用L-PBF技术制造了WE43镁合金多孔下颌骨植入物。2018年,Li等[78]研究了L-PBF技术制造的WE43镁合金多孔支架的力学性能、体外降解行为以及生物相容性,发现具有金刚石结构单元的多孔WE43支架即使在SBF中浸泡4周时间后,其力学性能与骨小梁相当,可提供适当的力学支撑;支架在SBF中浸泡4周后体积损失为20%;支架对MG63细胞的体外细胞毒性低于25%。2019年,Li等[75]进一步研究了增材制造的可降解多孔镁合金(WE43,金刚石单元体)的疲劳行为及其生物降解的影响,结果表明生物降解影响AM WE43镁合金支架的疲劳性能,使其疲劳强度从0.3σy降低到0.2σy;此外,循环加载加速了材料在r-SBF中的生物降解过程,材料的降解行为表现出位置依赖性,支架中心较支架外围表现出更显著的局部降解行为。2020年,Wang等[58]用L-PBF技术制备了3种具有相同孔隙率和平均孔径的JDBM镁支架,其单元结构分别为B (biomimetic)、G (gyroid)、D (diamond),通过压缩实验得到3种支架的屈服强度(YS)与弹性模量(E)分别为YS:4.07 MPa,E:0.207 GPa;YS:16.25 MPa,E:0.760 GPa;YS:9.40 MPa,E:0.466 GPa,通过间接细胞培养的方法得到,利用G单元结构支架15%浸提液培养MC3T3-E1细胞1 d后的细胞活性为109%,3 d后的结果为113%,利用经DCPD的表面涂层处理的G单元结构支架15%浸提液的结果为:培养1 d后的细胞活性为117%,3 d后的结果为119%,直接细胞培养的结果表明DCPD处理的支架显著促进了细胞的增殖。2021年,Hyer等[120]利用L-PBF技术制备了多种单元体结构的WE43镁合金多孔支架,通过对不同单元体结构WE43多孔支架进行压缩实验,可观察到2种主要的破坏模式:① 45°剪切破坏;② 重复破碎。此外,不同的单元体结构会影响材料的破坏模式。
与Mg相比,Zn的沸点更低、更易蒸发,锌基可降解金属增材制造中最大的问题是打印过程中的蒸发问题[24]。2016年,Montani等[122]使用L-PBF技术成形了纯Zn粉末,结果表明,由于纯Zn的低气化温度,导致其加工性能差,成型样品孔隙率高(12%),但L-PBF成形的Zn由于快冷速导致细晶强化,仍比铸态材料具有更高的力学强度,该工作证实了L-PBF技术加工生物可降解金属Zn的可行性。2017年,Demir等[63]关于改善L-PBF纯Zn成形部件致密度的研究表明,纯Zn的低气化温度使得成形过程中形成大量蒸气,封闭的成形舱中的气氛立即饱和,小颗粒悬浮在舱内,阻碍激光束的传播,导致激光束散射,使作用在粉床上的能量出现波动与衰减,诱发熔融不足、气孔等缺陷;在带有气体射流辅助的开放式成形舱中进行成形避免了该现象,当激光能量密度在40~115 J/mm3范围内时,获得了相对密度大于98%的立方体成形部件,在极有限的条件下,可获得约99%的相对密度。2018年,Grasso等[69]通过红外摄像机对Zn粉体蒸发烟尘和飞溅行为进行捕捉和统计后发现,PBF成形样品的致密度与粉体蒸发所产生的烟尘的行为直接相关。2018年,Wen等[59,115,117]系统地研究了成形参数对L-PBF成形的纯Zn材料显微组织、表面质量、致密度、力学性能的影响。利用特别设计的气体循环系统,一方面将密闭成形舱中的氧含量保持在50 × 10-6以下,另一方面通过辅助气体消除成形舱内Zn粉体蒸发所产生的烟尘,在合适的工艺参数窗口下,L-PBF成形样品可以达到超过99.50%的致密度,晶粒细小,力学性能优于传统制造工艺所制备的材料;通过化学抛光加电化学抛光的方法,可以有效改善L-PBF成形样品的表面质量。他们制备了三维多孔结构的纯Zn心血管支架,如图5c[59]所示,证明了L-PBF技术良好的成形能力。2019年,Qin等[116]将纯Zn粉与WE43粉体材料混合,利用L-PBF技术制备了不同成分的Zn-xWE43多孔支架(x = 0、2%、5%、8%,质量分数,下同),并研究了其成形质量、微观结构以及力学性能。结果表明,在相同的加工参数下,所有样品的致密度均可达到99.47%以上,Zn-8WE43表现出最大的孔隙率,表明最优的加工参数需要视具体材料成分而决定;成形样品的支架杆上附着大量粉体,导致样品实际孔隙率(45%)较设计值(67%)更小;微观组织方面,L-PBF技术的高冷速以及WE43的加入使得成形的样品晶粒细小,L-PBF成形的Mg-2WE43晶粒尺寸约为2 μm,随WE43含量的增多,Zn + Mg2Zn11共晶体的数量增多,样品抗拉强度增加,延伸率下降,而脆性MgZn2相的形成对试样的强度及塑性均产生不利影响。2019年,Li等[79]利用L-PBF技术制备了多孔锌支架,并对其力学性能、降解行为、生物相容性进行了综合性研究,通过压缩实验得到AM多孔锌的力学性能为E = 786 MPa,σy = 10.8 MPa,在r-SBF中动态和静态体外浸泡4周后体积损失率分别为7.8%和3.6%,细胞毒性实验结果表明,根据ISO 10993-5和ISO 10993-12,在72 h内,细胞活性良好,活-死细胞染色证实了在AM多孔锌表面培养的MG-63细胞具有良好的生存能力。2020年,Qin等[119]利用L-PBF技术制备了纯Zn块体样品,研究了扫描速率和成形方向对样品显微组织、力学性能及体外降解行为的影响。结果表明,对于显微组织,在300 mm/s的扫描速率下,可观察到沿成形方向的柱状晶粒以及<0001> // ND的强织构,随扫描速率增加,柱状晶粒逐渐细化,织构逐渐变弱;对于力学性能,在较高相对密度下,扫描速率的提高可以同时提高材料的强度和塑性,这是由于晶粒的细化所致。在给定的扫描速率下,平行于成形方向的样品,即垂直试样的强度和塑性均优于水平试样,L-PBF成形的纯Zn块体样品表现出较强的力学性能各向异性,这种各向异性是由晶粒择优生长方向与拉伸方向夹角引起的;对于腐蚀行为,在浸泡实验初期,试样腐蚀速率随扫描速率增加而增加,随浸泡时间延长,不同扫描速率样品间的腐蚀速率差别逐渐缩小,这是由于初期,晶粒细化对腐蚀速率影响占主导地位,随时间推移,腐蚀产物逐渐覆盖在样品表面,这种腐蚀产物的钝化作用降低了样品的腐蚀速率。2020年,Li等[81]制备了具有功能梯度的多孔锌支架(1.4 mm钻石单胞,支架杆厚度从0.4 mm到0.2 mm径向线性变化)以及其他2种均匀结构锌支架(支架杆厚度分别为0.3和0.4 mm),对其静态和动态生物降解行为、力学性能、渗透性和生物相容性进行了综合研究。结果表明,拓扑设计影响试件的降解行为,3种不同拓扑设计的样品之间的降解速率有150%的差异。在r-SBF中动态降解28 d后,3种样品表现出适中的降解速率,失重率在7%~11.9%,降解后样品的弹性模量、屈服强度与人体松质骨相当,在72 h的体外细胞毒性实验中,3种样品均表现出与Ti-6Al-4V相当的生物相容性。
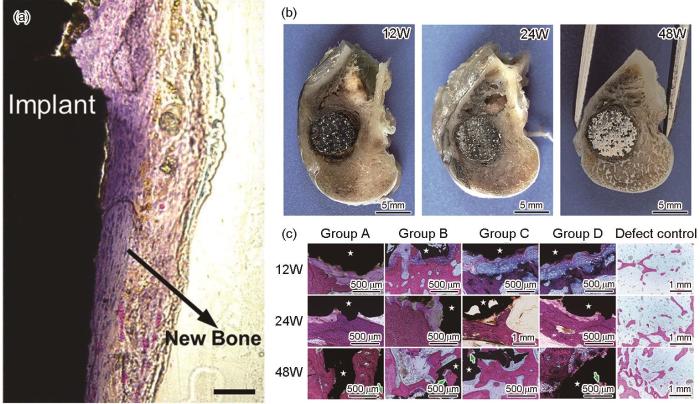
Fe在体内的降解速率偏慢,增材制造技术成形的多孔支架可以增大材料与腐蚀介质的接触面积,进而加快材料的腐蚀。2013年,Chou等[111]对通过黏结剂喷射技术成形的Fe-30Mn支架(孔隙率36.3%)进行了腐蚀行为、生物相容性的测试。电化学实验表明,铁锰支架的腐蚀速率明显快于纯Fe。利用MC3T3-E1细胞直接培养的方法,在支架表面以及支架的开放孔中均观察到细胞黏附,表明支架有良好的生物相容性。2014年,Song等[112,123]研究了L-PBF参数对铁显微组织以及力学性能的影响,发现在合适的参数窗口下可以获得几乎全致密的块体样品。L-PBF加工材料凝固过程快速的定向冷却导致细晶强化,同时高冷却速率引起了加工硬化,通过真空退火,基本消除了成形过程中积累的大量残余应力,显微组织由刚成形时的沿熔池温度梯度生长的柱状晶转化为细化的等轴晶。2016年,Montani等[122]研究表明,纯Fe与316L不锈钢的L-PBF成形参数以及成形样品质量相接近,2种材料的粉体都表现出优异的L-PBF可加工性。2018年,Yang等[98]用黏结剂喷射技术制备了纳米羟基磷灰石涂层的纯Fe多孔支架。2018年,Li等[80]首次用L-PBF方法制备了金刚石单胞结构的纯Fe多孔支架,并研究了多孔支架的力学性能、体外降解行为及生物相容性,在r-SBF中浸泡28 d后,多孔铁支架失重率为3.1%,其降解速率为块体冷轧铁的12倍,浸泡4周后,多孔铁的弹性模量和屈服强度下降分别为7%和5% (E = 1600~1800 MPa)。同年,Li等[77]研究了相同结构的多孔铁支架的腐蚀疲劳行为,支架在空气和r-SBF中的疲劳强度分别为屈服强度的70%和65%,AM多孔Fe表现出优异的耐疲劳性,主要原因是其降解速率慢且塑性好。此外,在较高的应力水平,交变载荷显著提高材料的降解速率。2019年,他们用L-PBF方法制备了具有功能梯度的纯Fe多孔支架[82]。2019年,Carluccio等[118]进行了L-PBF成形的铁基可降解金属支架(图5d[118])的体内实验,支架植入大鼠颅骨缺损4周后观察到新生骨与种植体表面直接接触(如图6a[118]所示)。2020年,Nie等[121]通过L-PBF制备了Fe-30Mn支架并将其植入新西兰白兔股骨髁缺损,48周的体内实验结果表明,多孔的Fe-30Mn支架在12~48周与宿主骨逐渐紧密结合(图6b[121])。图6c[121]为Fe-30Mn支架植入A~D组和缺损对照组植入不同时间的组织学染色结果,在术后12周,A~D组Fe-30Mn支架周围均可观察到新形成的骨小梁,术后24周,支架边缘及骨-支架界面的新骨染色更加明显,术后48周,支架边缘和内部孔隙处的成熟新骨增多。在体内降解48周后,支架体积减少10.1%~20.9%,弹性模量降低34.1%~42.3%,屈服强度降低15.8%~23.3%。上述工作表明,L-PBF技术制备的铁基可降解金属在修复承重部位骨缺损部位表现出应用潜力。
图6 AM多孔铁支架体内实验结果,包括:Fe-35Mn支架植入大鼠颅骨缺损4周后的组织学影像[118],Fe-30Mn支架植入不同时间后股骨髁切片[121],及Fe-30Mn支架(A~D)组和缺损对照组在不同时间后的组织学染色[121]
(a) histological image of Fe-35Mn scaffold after implantation in the rat cranial bone defect for 4 weeks[118]
(b) the femoral condyle sections obtained at 12, 24 and 48 weeks, respectively for porous Fe-30Mn scaffolds[121]
(c) the histological stain for porous Fe-30Mn scaffolds (groups A-D) and defect control at 12, 24 and 48 weeks, respectively (White stars indicate the black areas; the areas in purple indicate the new bone tissue; green arrows indicate the new bone tissue in the pores; groups A-D: porous Fe-30Mn scaffolds with the same pore size of 400 μm and the strut sizes of 300, 400, 500, and 600 μm, respectively)[121]
Fig.6 In vivo evaluation of AM porous Fe scaffolds
L-PBF技术成形的样品的微观组织与粉体材料成分及成形过程的工艺参数有关,Shuai等[124]发现,L-PBF成形的镁合金样品在Ev为420、500、600和750 J/mm3时,晶粒尺寸分别为2、4、6和8 μm。与传统铸造工艺中的1~102 K/s相比,L-PBF期间的冷却速率可以达到105~106 K/s[102],这使得L-PBF技术成形试样较传统制备方法所得材料晶粒更为细小[125,126],且由于垂直于基板方向的热流梯度最大,试样组织产生了各向异性[123],DebRoy等[23]得出结论L-PBF hcp结构金属的优先生长方向为<
通过对成形参数及成形过程的优化,利用L-PBF技术已可以得到接近全致密的金属植入物。图7a[59,112,115,116,119,123,125,127~136]汇总了文献报道的L-PBF成形的可降解金属与传统惰性金属的力学性能数据,和铸造热加工后的块体材料规律是一样的,可降解金属在力学强度及延伸率上与传统惰性金属尚存在一定的差距。在L-PBF成形的可降解金属中,铁基可降解金属表现出最优异的力学性能,其次是镁基可降解金属,锌基可降解金属的力学强度最低,主要是因为迄今关于锌基可降解金属的工作主要集中在以纯Zn粉体为原料,以Zn合金粉体[116,128,137]为原料进行L-PBF成形的报道较少。
图7 L-PBF成形块体医用金属材料的拉伸性能[59,112,115,116,119,123,125,127~136],L-PBF成形多孔可降解金属的压缩屈服强度与弹性模量之间的关系[58,78~81,118,121,142],L-PBF成形可降解金属的降解速率[78~80,118,119,121,128,137,144,145],及MG63及MC3T3-E1细胞在L-PBF成形可降解金属浸提液中的细胞成活率(未标出部分为MG63细胞的结果)[58,78~81,118,121,128,137,151,152]
Fig.7 Tensile properties of bulk medical metallic materials manufactured by L-PBF (a)[59,112,115,116,119,123,125,127-136], elastic modulus-compressive yield strength relationship of biodegradable scaffolds manufactured by L-PBF (b)[58,78-81,118,121,142], biodegradation rates of L-PBF biodegradable metals (c)[78-80,118,119,121,128,137,144,145], and cell viability of MG63 and MC3T3-E1 cell lines in L-PBF biodegradable metals' extractions (The unmarked parts are the cell viabilities of MG63) (d)[58,78-81,118,121,128,137,151,152]
理想的骨科植入物需要有足够的力学强度且与周围的骨组织相匹配,并能在骨组织愈合的过程中提供力学支撑,有优异的应力传导能力[138]。人体皮质骨的拉伸屈服强度为53 MPa (测试方向与骨轴垂直)、124~174 MPa (测试方向与骨轴平行),压缩屈服强度为1~20 MPa,抗压强度为103~140 MPa,弹性模量为1~35 GPa;骨小梁压缩屈服强度为2~12 MPa,弹性模量为0.1~5 GPa[118,139]。需要注意的是人体骨的力学性能与年龄、骨的健康状况以及骨的类型密切相关[118]。块体AM纯Mg的弹性模量在27~35 GPa,块体AM锌基可降解金属的弹性模量在12~58 GPa,均与人皮质骨的弹性模量相近,但AM纯Mg的拉伸屈服强度(51 MPa)[140]略低于人体皮质骨,通过合金化的方法,合金元素固溶在基体中起到固溶强化的效果,也可以在一定程度上细化晶粒,同时生成的第二相起到沉淀强化的效果,使得AM成形的ZK91D合金的拉伸屈服强度可以达到254 MPa[131],优于人体皮质骨,达到可降解金属骨固定器械对屈服强度的要求(> 230 MPa)[141]。AM纯Zn的拉伸屈服强度相对较低(43~122 MPa)[59,115,119,128]。通过合金化的方法在纯Zn中加入2%Mg (利用球磨机将纯Zn粉体与纯Mg粉体混合),使其拉伸屈服强度由43 MPa提升至152 MPa[128]。
图7b[58,78~81,118,121,142]汇总了L-PBF成形多孔可降解金属的压缩屈服强度与弹性模量之间的关系,现有工作中,多孔镁的弹性模量在0.207~0.8 GPa[58,75],压缩屈服强度为4.07~23 MPa[58,75],抗压强度为13~31 MPa[58,75,97],多孔锌的弹性模量在0.4~0.8 GPa之间[79,81],压缩屈服强度在4~12 MPa之间[79,81]。对于AM多孔铁,通过对其孔隙结构的设计,可实现多孔铁的弹性模量(2~33.5 GPa)[80,118,121]与皮质骨相当,且相比于多孔镁和多孔锌,仍具有相对高的压缩屈服强度(24~241.4 MPa)[80,118,121]。不同孔隙率的L-PBF成形的FeMn30多孔支架[121],在兔体内植入48周后,弹性模量降低34.1%~42.3%,屈服强度降低15.8%~23.3%,材料与股骨髁组成的复合体与正常对照组具有相同的刚度水平。
除静态力学性能指标外,由于承重部位的骨科植入物在人体内每年需要承受数百万次的循环载荷[28],因此AM可降解金属的疲劳行为也非常重要。AM多孔可降解金属的疲劳行为受材料类型、成形质量、几何结构、生物降解、成形后处理等因素影响。材料类型方面,Li等[75~77]的研究工作表明,在相似结构设计下,AM多孔纯Fe和纯Zn较AM多孔镁合金(WE43)显示出更高的疲劳强度。成形质量方面,试样的表面粗糙度以及试样内部的微孔等缺陷可能作为裂纹的形核位点,并影响裂纹的扩展,AM锌的成形缺陷可以作为裂纹的起始点,缩短其疲劳寿命[56]。几何结构方面,Li等[75~77]对于钻石单元结构的AM多孔可降解金属的疲劳行为研究表明,疲劳裂纹倾向于在2根支架杆之间的连接处形核,这是由于该位置在压缩状态下会出现拉伸应力集中的现象。生物降解方面,在r-SBF中,生物降解行为会降低AM多孔镁合金(WE43)和AM多孔铁的疲劳寿命[75,77],但在r-SBF中浸泡的AM多孔锌的疲劳寿命优于在空气中测试的结果,这可能是由于形成的降解产物与AM多孔锌之间良好的结合[76]。成形后处理方面,表面喷砂处理已被证明可以改善AM多孔钛的耐疲劳性[143],HIP已被用来改善AM多孔Ti-6Al-4V的疲劳强度与疲劳极限[99,100],研究喷砂处理等表面处理手段以及HIP等热处理工艺对于AM可降解金属力学性能的影响有重要意义。目前,对于AM多孔可降解金属支架疲劳行为的研究较少,仍需要对此进行探索。
对于理想的骨科可降解金属植入物来说,根据临床要求的不同,植入物需要提供12~24周的力学支撑[12]。对于骨板和骨螺钉,通常需要腐蚀速率小于0.5 mm/a[141]。这意味着需要对AM可降解金属的腐蚀速率进行调控。图7c[78~80,118,119,121,128,137,144,145]总结了L-PBF成形可降解金属在不同浸泡介质中的降解速率。Qin等[119]通过L-PBF技术成形的块体纯Zn在Hank's溶液中的腐蚀速率为0.048~0.128 mm/a (电化学实验)和0.038~0.042 mm/a (浸泡实验),较传统铸造纯Zn在Hank's溶液中的腐蚀速率(0.027~0.325和0.011~0.084 mm/a)更低,这是由于L-PBF技术的快冷速所造成的细晶组织以及腐蚀产物的钝化作用的原因。Li等[75~77]通过L-PBF技术成形的AM多孔WE43、AM多孔纯Zn、AM多孔纯Fe在r-SBF中浸泡28 d后的腐蚀失重率分别为20%、8%和3%,这与传统熔炼方法制造的块体可降解金属规律相吻合。
可降解金属中合金化元素的加入主要从晶粒尺寸(钝化环境中,由于腐蚀产物的形成,细晶结构可能导致腐蚀速率降低[24],具体情况与金属表面的钝化性质有关[146])以及析出的第二相与基体间的电偶腐蚀2方面来影响AM可降解金属的腐蚀速率[147,148]。Zhou等[140]对L-PBF成形的Mg-Sn合金的腐蚀行为研究发现,随Sn元素含量的增加(0、1%、3%、5%、7%),材料的腐蚀速率呈现先下降后上升的趋势,这是由于晶粒细化对腐蚀速率的减慢效果大于第二相引起的电偶腐蚀对腐蚀速率的加速效果,当Sn含量较高时,第二相对腐蚀速率的影响占主导作用。Gao等[149]探讨了Mn、Sn元素对L-PBF技术制备的镁合金耐蚀性的双重合金化效应,与AZ61合金相比,AZ61-0.4Mn-0.8Sn合金的腐蚀速率约降为一半,这主要是由于表面的保护层,其中富含Mn和/或Sn的相作为屏障有效阻止了介质的渗透,从而保护基体。Guo等[150]研究了具有L-PBF工艺成形具有抗菌性的Fe-xCu (x = 0、1.5、2.3、7.8、10.1,质量分数,%)合金的降解行为,结果表明L-PBF成形的Fe-1.5Cu、Fe-2.3Cu和Fe-10.1Cu的降解速率与纯Fe相似,而Fe-7.8Cu的降解速率为纯Fe的2.5倍,这是由于合金表面大量的富Cu相可以接触到腐蚀介质,溶出更多铜离子,破坏富Cu相周围的钝化膜的连续性,Fe基体上的钝化膜保护作用减弱,因此,随着更小的晶粒和更大的晶界体积,增加的富Cu相对加速降解的影响不能被钝化膜形成对减缓降解的影响所抵消。
值得一提的是,AM多孔可降解金属的独特优势在于可以通过其结构的致密度设计来调控腐蚀速率。孔隙的引入增大了材料自由面积,一定程度上加速材料降解。Carluccio等[118]通过L-PBF制备的纯Fe多孔支架的腐蚀速率为0.062 mm/a (电化学实验),接近传统铸态纯Fe腐蚀速率的8倍 (0.008 mm/a)。对于本身块体材料降解速率偏快的可降解镁合金来说,为了避免其在植入早期的快速降解所产生的大量H2及力学稳定性的丧失,需要对AM多孔镁合金支架单元体进行合适的设计,并对其进行适当的打印成形后处理手段。Li等关于AM功能梯度多孔Zn[81]以及AM功能梯度多孔Fe[82]的工作发现材料的腐蚀速率与支架的孔隙率相关。Nie等[121]对AM多孔FeMn30的研究工作也发现类似的规律,孔隙率不同的4组材料在兔体内植入48周后体积损失率为10.1%~20.9%。值得注意的是,在AM多孔可降解金属支架中观察到支架的降解行为与位置相关[78~80]。
目前关于AM多孔可降解金属植入物体外和体内生物相容性研究数据较少。对于AM锌基可降解金属以及AM镁基可降解金属的生物相容性评价仍停留在细胞相容性水平,如图7d[58,78~81,118,121,128,137,151,152]所示。仅有L-PBF技术成形的铁锰支架的工作进行了动物的体内植入实验[118,121],影响可降解金属生物相容性的因素主要在于其化学性质以及降解产物,因此未来AM可降解金属的粉体材料成分设计也必须要遵循块体可降解金属设计的基本原则,即满足生物相容性和可生物降解性[13]。
对于AM块体可降解金属材料,其晶粒组织较传统工艺的材料更为细小,且可能存在织构,这些因素对于材料生物相容性的影响暂时没有定论[153~155],AM块体可降解金属整体表现出与传统工艺制造的可降解金属相仿的细胞生物相容性。
对于AM多孔可降解金属,其优势在于支架的孔隙可以成为营养物质运输以及代谢产物排泄的通道,且有利于新生组织的长入。并且,AM多孔材料的几何结构和微观组织不同于常规的块体材料,导致不同的生物降解行为,进而间接或直接地影响细胞的反应,因此可以通过调控支架的孔隙结构,影响其生物相容性。目前,还没有关于AM可降解金属的几何结构设计对于生物学行为影响的相关研究,但关于AM多孔钛合金的几何设计对于细胞响应行为已被广泛研究,钛合金支架的孔隙率以及单元体的形状均会影响细胞行为[156,157]。Zadpoor[158]指出,组织生成的速率随着多孔支架曲率的增加而增加,并且在凹表面上比在凸表面和平面上快。有关AM多孔钛合金的几何设计对细胞行为影响的相关研究为后续设计AM多孔可降解金属提供了一定借鉴。
AM成形试样的表面形貌会影响植入体与机体之间的反应。成形态的样品表面大多沾有粉末颗粒,这会增加细菌定植的风险。研究表明,纳米级表面拓扑形貌结构能诱导间充质干细胞(MSCs)的成骨分化,促进成骨细胞黏附,有望改善植入物在体内的骨整合性能[159,160],为未来AM可降解金属的表面形貌设计提供了思路。
本文综述了医用金属材料增材制造的研究现状。生物惰性金属的增材制造目前已经取得了较为广泛的临床应用,主要采用了EB-PBF和L-PBF工艺。以生物可降解金属的增材制造仍然处在基础研究阶段,由于Mg和Zn的蒸发倾向较高,主要使用的工艺为L-PBF。根据现有的国内外研究现状和科技发展趋势,在未来的生物可降解金属增材制造研究中,需要对以下几方面重点突破。
目前,尚无通过验证的商用可降解金属粉体材料,粉体材料的标准化和商品化成为限制其增材制造研究和应用的主要原因之一。目前使用的生物可降解金属都是基于传统制造工艺开发的,镁基和锌基可降解金属打印过程中,金属蒸发烧损造成的化学成分变化,使得打印件和原始粉末的成分出现较大偏差。当含有多种合金元素时,不同合金元素的蒸发速率不同,甚至相差较大的时候,最终打印件的化学成分可能远远偏离初始粉末的成分,对其组织和性能可能带来重要影响。受粉末反复熔化和快速凝固等物理过程影响,打印态和传统制造的显微组织有较大区别,已有的可降解金属材料成分优化方案未必适合增材制造工艺。除了粉末的化学成分,粉末的处理工艺及其形态特征对增材制造工艺有重要影响。良好的粉末流动性及铺粉质量是可靠性能的基本保障。因此,根据可降解医用植入物的临床性能和制造工艺需求,开发增材制造专用的粉体材料,是亟需解决的关键技术问题。
增材制造技术的最大优势在于个性化复杂几何结构的高效率和高精度实现,骨科植入物的多孔结构就是一个典型的代表。然而,目前医用植入物的设计准则和方法均基于钛合金等传统的生物惰性金属或块体金属等传统的结构形式,没有考虑降解对结构设计的影响,无法充分发挥增材制造和可降解金属相结合的“1 + 1 > 2”的优势。对于可降解金属而言,随着材料的降解和新组织的生长,可降解金属植入物的力学特性不断在发生变化。此外,降解是一种表面反应,几何结构对降解行为的影响不容忽视。例如,多孔结构增加了植入物表面积,将大大增加其降解速率,而降解行为又影响力学性能和生物相容性。研究降解行为如何影响支架的结构完整性、力学承载能力和生物相容性等十分重要,利于充分发挥增材制造的设计柔性。
Mg和Zn的熔点和沸点低,蒸发倾向较高,金属蒸发产生的烟尘和对熔池的反冲力对稳定熔化过程有重要影响;Mg的活性高、易氧化、热膨胀系数较高,易产生热裂纹。因此,相较于钛合金和不锈钢等生物惰性金属,镁基和锌基可降解金属的增材制造工艺存在较大特殊性,对植入物的材料成分、结构设计和性能优化有重要影响。如果增材制造工艺选择不当,可降解植入物内部和表面容易产生成形缺陷,显著影响植入物的力学性能和降解行为。增材制造工艺(能量输入、扫描策略和舱室气氛等)对可降解植入物的微观组织亦有重要影响,从而影响植入物的力学性能和降解行为。尽管L-PBF的尺寸精度在所有金属增材制造工艺中相对较高,但成形件和设计值之间不可避免存在尺寸误差,而表面粉末黏附带来较大的表面粗糙度对疲劳和降解有重要影响,因此需要采用喷砂和化学抛光等后处理的方法改善表面质量,而热处理则可以进一步调控微观组织,对其整体的力学性能和降解行为进行调控。目前可降解金属的增材制造主要采用激光逐层熔化粉体材料,涉及到熔化、蒸发、凝固和固态相变等物理过程,材料的成分、结构和性能发生了剧烈变化,其工艺特点和物理过程不利于多种材料的混合打印,限制了复合材料和结构的创新,因此有必要开发其他高可靠性、高精度和高柔性的增材制造工艺。
目前对可降解金属的性能评价多基于传统加工工艺,增材制造多孔结构可降解金属的性能评价尚存在较大空白,特别是其降解行为、力学性能和生物相容性在服役期的变化。首先,增材制造多孔结构可降解金属的疲劳和蠕变等力学性能变化尚不清楚。其次,增材制造多孔结构可降解金属的动物体内试验数据较少,而现有的体外电化学试验和体外浸泡试验无法准确反映植入物在生物体环境下的降解行为,因此,如何设计真实反映植入物的临床服役状态的评价方法有待进一步探索。由于可降解金属植入物需要评价的性能指标多、评价周期长、性能的影响因素多,完全通过实验评价的效率低、成本高。因此,结合实验数据利用数值模拟和机器学习等人工智能方法建立高效可靠的虚拟评价方法,有望成为未来可降解金属植入物成分优化和结构设计的有效方法。
调控降解速率与人体组织修复过程相适配是个性化可降解金属植入物临床应用的关键。镁基可降解金属的降解速率偏快,锌基和铁基可降解金属的降解速率偏慢。尽管国内外开发了多种合金体系和制造工艺来调控可降解金属的降解速率,但绝大多数工艺是针对传统制造的块体金属。除了优化合金成分、结构设计和增材制造工艺外,功能化表面处理是实现降解速率调控必不可少的关键技术。通过抛光、快速凝固、合金化和涂层等表面技术,可大幅改善可降解金属植入物的降解行为。此外,表面处理还可改善其促成骨、抗菌、抗炎等生物功能。
尽管可降解金属在血管支架和骨科植入物等方面已经取得了可喜的临床应用效果,但增材制造可降解金属植入物的临床应用尚未实现。将个性化多孔结构的骨科植入物用于骨缺损治疗是最有可能取得突破的临床应用。然而,骨缺损植入物的降解速率需要和骨组织再生速率匹配,为了实现增材制造可降解金属植入物的临床应用,需要根据临床需求来设计植入物,通过材料成分、结构设计和制造工艺来优化植入物性能,并对其性能进行准确评估,这是一个充满挑战的跨学科难题,需要材料、机械、信息、生物、医学等多学科交叉来共同完成。
1 可降解金属成为21世纪医用金属研究领域的热点
Property
Performance
Zinc and its alloys
Magnesium and
Iron and its alloys
its alloys
Mechanical
Yield strength (YS) / MPa
126-389
149-293
106-950
property
Ultimate tensile strength / MPa
167-647
199-350
169-1550
Ultimate compressive strength / MPa
99-457
90-258
312-696
Elongation / %
6-84
8-28
1.3-94
Hardness
44-217 HV
35-90 HB
175-428 HV
Elastic modulus / GPa
94-110
41-45
77-211
Corrosion
In vitro corrosion rate (SBF,
0.16-1.66
0.45-12.56
0.17-1.30
behavior
electrochemical test) / (mm·a-1)
In vitro corrosion rate (SBF, static
0.014-0.03
0.07-1.88
0.028-0.250
immersion test, 30-60 d) / (mm·a-1)
In vivo corrosion rate (rats femur
0.13-0.26
0.36-1.58
No significant
model, volume loss, 8-12 weeks)
degradation
/ (mm·a-1)
Type
Uniform corrosion/
Localized corrosion/
Uniform corrosion/
localized corrosion/
pitting corrosion
localized corrosion/
pitting corrosion
pitting corrosion
Main cathodic reactions
Redox reaction
Hydrogen
Redox reaction
evolution reaction
Gas in biodegradation products
None
Hydrogen
None
Soluble biodegradation products
Zn2+, OH-
Mg2+, OH-
Fe2+, Fe3+, OH-
Insoluble biodegradation products
Zn(OH)2/ZnO
Mg(OH)2/MgO
Fe(OH)3/Fe2O3/Fe3O4
Biocompatibility
Essential elements in bone
Yes
Yes
No
metabolism
Content in humans / g
2
25
4-5
Concentration in serum / (mmol·L-1)
0.012-0.017
0.73-1.06
0.009-0.029
Average daily intake in diet / mg
8.6
329
1.1
Recommended daily allowance / mg
12-15
280-350
8-18[14]
IC50 osteoblasts / (mmol·L-1)
0.09
> 4.02
0.328-0.583
0.13
66.7
LD50 / (mmol·L-1)
350
5000
1300
Classification
Material
Benefit
Limitation
Application
Bio-inert
316L SS
Acceptable biocompatibility, good
High elastic modulus, localized
● Joint arthroplasty
metals
corrosion resistance and MRI
corrosion with pitting, crevices and
● Bone defect repair
compatibility, low cost
stress corrosion cracking
● Dental implant
Co-Cr
High mechanical strength,
High elastic modulus, biological
● Dental (orthodontic
alloys
excellent corrosion, fatigue and
toxicity
wire)
wear resistance
● Craniofacial
● Spinal
● Orthopedic
Ti alloys
Superior biocompatibility, good
Poor tribological characteristics,
● Bone defect repair
corrosion resistance, mechanical
fatigue strength, expensive,
● Bone scaffold
strength, light weight
incompatibility between the
● Spinal fusion
elastic modulus of bone and
● Joint arthroplasty
the Ti implant material
Biodegradable
Mg-
Good biocompatibility,
Excessive degradation rate, high
● Cardiovascular stents
based
biodegradable in the physiological
H2 gas evolution, unwanted pH
● Orthopedic fixation
metals
alloys
environment, ability to stimulate
increase in surrounding tissue,
bone formation and elastic modulus
premature loss of mechanical
close to natural bone, MRI
integrity before sufficient
compatibility
tissue healing
Zn-based
Intermediate corrosion rate (faster
Age hardening, excessive release
● Cardiovascular stents
alloys
than Fe-based alloys, slower than
of Zn2+ during degradation results
● Orthopedic fixation
Mg-based alloys), fair
in cytotoxicity in vitro and delayed
compatibility, no gas evolution
osseointegration in vivo
Fe-based
High strength, high ductility, MRI
Low corrosion rate, high elastic
● Cardiovascular stents
alloys
compatibility, fair
modulus
biocompatibility, gas evolution
2 增材制造医用金属植入物的研究从传统金属向可降解金属进发
AM methodology
Characteristic
Vat polymerization
The build platform is lowered into a vat of liquid photopolymer resin. A UV light cures the
resin in layers on top of the platform.
Alternative name: SLA—stereolithography apparatus, DLP—digital light processing
Resolution: 10 μm
Material jetting
Droplets of material are deposited onto the surface using a thermal or piezoelectric method.
Each layer is cooled or cured by UV light.
Alternative name: inkjet printing, MJM—multi-jet modeling
Resolution: 25-100 μm
Material extrusion
A material spool is fed and melted through a heated nozzle and deposited onto the surface,
layer by layer.
Alternative name: FDM—fused deposition modeling
Resolution: 50-200 μm
Powder bed fusion
The material in powder form is spread over the surface and fused to other layers using a laser
or electron beam.
Alternative name: SMS—selective metal sintering, SHS—selective heat sintering, DMLS—
direct metal laser sintering
Resolution: 80-250 μm
Binder jetting
Building material in powder form is rolled/spread into a flat sheet. A liquid binding agent is
selectively applied between layers as an adhesive.
Alternative name: PB—powder bed printing
Resolution: 80-250 μm
Sheet lamination
Material in sheet form is placed on a cutting bed and bonded over the surface using an
adhesive. Each layer is cut to shape by laser, knife, or drill after bonding.
Alternative name: UC—ultrasonic consolidation, LOM—laminated object manufacturing
Resolution: depends of thickness of laminates
Direct energy deposition
Material, typically in the form of a powder or wire, is deposited onto the surface and melted
using a laser or electron beam upon deposition.
Alternative name: LMD—laser metal deposition, LENS—laser engineered net shaping
Resolution: 250 μm
2.1 传统金属的增材制造
2.1.1 Ti及钛合金
图1
2.1.2 钴基合金
2.1.3 不锈钢
2.2 可降解金属的增材制造
(1) 粉体制备
图2

(2) 成形过程工艺参数
图3
(3) 结构设计
图4
(4) 成形后处理工艺
2.2.2 增材制造可降解金属植入物的研发历程
图5

(1) 增材制造镁基可降解金属植入物
(2) 增材制造锌基可降解金属植入物
(3) 增材制造铁基可降解金属植入物
图6
2.2.3 增材制造可降解金属的性能(1) 力学性能
图7

(2) 降解行为
(3) 生物相容性
3 展望
(1) 可降解金属增材制造用粉体材料的研发
(2) 增材制造可降解金属植入物的结构设计
(3) 可降解金属植入物的增材制造工艺
(4) 增材制造可降解金属植入物的性能评价
(5) 增材制造可降解金属植入物的降解调控和表面处理
(6) 增材制造可降解金属植入物的临床应用
来源--金属学报







 沪公网安备31011202020290号
沪公网安备31011202020290号
