分享:富Fe红壤中管线钢的硫酸盐还原菌腐蚀行为
于利宝
摘要
采用电化学阻抗谱(EIS)、极化扫描和循环伏安(CV)等电化学技术,结合SEM表面形貌分析技术,研究高强度低合金X80管线钢在富Fe酸性红壤环境中的硫酸盐还原菌(SRB)腐蚀行为及电化学过程。结果表明,酸性红壤环境中,环境适应期(前7 d) SRB对腐蚀电化学过程没有明显影响;SRB生长期的呼吸代谢活动导致X80钢的自然腐蚀电位降低,显著促进了管线钢的腐蚀过程;SRB通过胞外铁呼吸可与红壤颗粒表层FeOOH/Fe2O3等铁氧化物发生作用,引起FeOOH/Fe2O3的微生物异化还原,该过程中,SRB作为电子传输媒介,参与Fe和氧化铁间的电子转移,该机制是SRB促进局部腐蚀电化学过程的主要原因。提出了SRB促进红壤中管线钢微生物腐蚀(MIC)与胞外铁呼吸机制之间的联系。
关键词:
硫酸盐还原菌(SRB)广泛存在于土壤环境中,是影响埋地金属腐蚀的最典型细菌[1,2]。微生物导致的腐蚀(MIC)在材料腐蚀失效中占重要比例。SRB通过分泌胞外聚合物形成生物膜黏附着于金属表面,对基体材料造成严重的腐蚀[3]。SRB一般利用分子氢、脂肪酸、脂肪烃等有机物作为C源和电子供体以维持生命所必需能量[4]。目前人们对SRB影响腐蚀的机理已有较为深入的认识,广泛接受的机理有阴极去极化理论[5]、代谢产物腐蚀理论[6]、阳极催化理论和直接电子转移理论[7]等。这些理论均认为与代谢相关的氧化还原和电子交换过程均发生于细胞内(SRB只能将电子传递给跨膜扩散到细胞内的可溶性硫酸盐),尚不涉及细胞与高价金属氧化物之间电子交互过程及微生物铁呼吸反应[8~10]。
传统研究中一般认为SRB的呼吸过程为硫酸盐呼吸,即SRB以SO42-为电子受体氧化有机物,通过对有机物的异化作用,获得生存所需的能量,维持生命活动。而有研究[11,12]表明,SRB呼吸途径多样,硫酸盐并非其生存的必要条件,在SO42-缺乏环境中,SRB可调整呼吸代谢行为,通过其它的呼吸代谢方式生存和生长,例如,SRB可利用Fe(III)、Mn(IV)等作为终端电子受体。有研究[11,13]表明,以胞外不溶性Fe(III)作为末端电子受体的铁呼吸作用,普遍存在于富Fe沉积物和土壤环境中。Liu等[14]观察到SRB在还原富Fe黏土矿物过程中会产生“纳米导线”结构,提高了电子在微生物细胞和细胞外电子受体/供体之间的传递效率[8,15,16]。
酸性红壤广泛分布于长江以南、青藏高原以东的华南区域, 是我国典型的高腐蚀性土壤之一。红壤呈酸性、含水量高、含盐量低且电阻率高,红壤的腐蚀性强,其腐蚀机理不同于中性/碱性土壤[17~19]。影响红壤腐蚀性的因素众多,包括pH值、潜性酸、含水量、干湿过程及微生物等,最近的研究[19,20]表明,红壤的高腐蚀性与其黏土矿物特性密切相关。红黏土主要成土矿物为高岭石和铁氧化物,后者一般以赤铁矿(α-FeOOH)和针铁矿(α-Fe2O3)的形式富集于高岭石颗粒表面,与管线钢接触时,FeOOH/Fe2O3可作为阴极去极化剂,促进管线钢的电化学腐蚀过程。
FeOOH/Fe2O3矿物在红壤腐蚀中的作用已有报道,而微生物对红壤腐蚀过程的影响仍尚未引起关注。SRB通过胞外铁呼吸与土壤矿物或腐蚀产物中的FeOOH/Fe2O3发生作用,必将影响红壤矿物质转变和碳钢的腐蚀动力学过程[21]。本工作采用电化学阻抗谱(EIS)、恒电位极化扫描、循环伏安(CV)等电化学技术,结合扫描电镜(SEM)表面形貌分析,研究酸性红壤中SRB与红壤FeOOH/Fe2O3共同作用下X80管线钢的腐蚀电化学行为。
实验材料为X80高强度管线钢,其主要化学成分(质量分数,%)为:C 0.07,Mn 1.82,Si 0.19,P 0.007,S 0.023,Cr 0.026,Ni 0.17,Cu 0.020,Al 0.028,Mo 0.23,Ti 0.012,Nb 0.056,V 0.002,N 0.004,B 0.0001,Fe余量。试样由环氧树脂封固,裸露工作面积为10 mm×10 mm,实验前试样工作表面用水砂纸逐级打磨至1000号,依次用去离子水、丙酮、无水乙醇清洗,吹干,储存于干燥器中备用,实验前用紫外灯灭菌,避免杂菌污染。
实验所用土壤采自国家材料环境腐蚀试验站江西鹰潭酸性土壤中心站。土壤取自地下1 m,经自然风干后,在105 ℃下干燥10 h,机械碾磨后用直径1 mm的分析筛进行筛选。鹰潭土壤为第四纪红黏土,pH值为3.95 (水土比为2.5:1),浸出液中(水土比为2.5:1) SO42-含量小于0.001% (质量分数),其具体理化性质详见文献[19,20]。
细菌培养基采用API RP-38溶液,其成分为:乳酸钠4.0 g,酵母膏1.0 g,MgSO47H2O 0.2 g,NaCl 10.0 g,K2HPO4 0.5 g,抗坏血酸0.1 g,(NH4)2Fe(SO4)2 0.02 g,蒸馏水1000 mL,用1 mol/L的NaOH调节pH值至7.0~7.2之间,经N2除氧和高温灭菌后低温保存。实验所用SRB取自国家材料环境腐蚀试验站沈阳土壤中心站。菌种保存在4 ℃环境中,实验前菌种在30 ℃恒温箱活化12 h,以提高活性。
实验用土壤、去离子水、钢试样、广口瓶、辅助电极等实验材料使用前均经高温灭菌处理。取1000 g干燥红壤与350 g去离子水在广口瓶中混成水饱和泥浆,将50 mL细菌培养基接种到泥浆中,灭菌对照组用50 mL灭菌培养基代替细菌培养基,充N2除O2后密封。实验在30 ℃恒温水浴锅中进行,周期为60 d。实验过程中由吸管定期抽取泥浆,采用最大可能计数法(MPN)测量接菌红壤体系中SRB的数量。实验开始和结束时利用DDS-307电导率仪测试泥浆的电导率。
电化学测试使用PARSTAT 2273测试系统。实验采用经典的三电极体系,工作电极为X80钢,辅助电极为大面积Pt片,参比电极为饱和甘汞电极(SCE)。EIS测量激励信号为10 mV的正弦交流波,测试频率范围为10-2~105 Hz,数据由ZSimpWin软件拟合处理。微生物(膜)的电活性特征由其在玻碳电极上的循环伏安曲线(电位扫描速率5 mV/s)表征。极化曲线测量时从开路电位(EOCP)→-1000 mV→-500 mV,电位扫描速率为0.166 mV/s。
实验结束后,将接菌试样用蒸馏水清洗后,迅速进行微生物固定及脱水处理,超临界干燥后采用Philips FEG XL30 SEM观察试样表面腐蚀产物形貌,并通过SEM自带的能谱仪(EDS)对试样表面产物进行元素分析,之后将试样浸入除锈剂(500 mL盐酸+500 mL去离子水+20 g六次甲基四胺)中去除腐蚀产物,并用去离子水清洗吹干,利用SEM观察腐蚀形貌。
X80管线钢试样在灭菌和接菌2种红壤环境中浸泡60 d后表面腐蚀产物形貌的SEM像如图1所示,对应的EDS分析结果示于表1。可以看出,无菌红壤中,管线钢试样表面失去原有金属光泽,并附着一层红壤黏土颗粒,EDS结果显示其主要成分为Fe、Al、Si的氧化物,它们是红壤黏土矿物的主要组成成分,其中部分Fe来源于腐蚀产物;接菌红壤中,X80管线钢试样表面也黏附一层红壤,高倍SEM下可以清楚观察到有大量SRB附着,EDS分析显示存在S,这与SRB的生理活动相关。Fe含量相对减少,可能是红壤中的固态Fe(III)被SRB异化还原变为可溶态所致。
图1 灭菌和接菌2种红壤环境中浸泡60 d后X80管线钢表面腐蚀产物形貌的SEM像
Fig.1 Surface SEM images of corrosion product of X80 steel samples immerged in sterile (a~c) and sulfate reducing bacteria (SRB) inoculated (d~f) red soils for 60 d
表1
Table 1 EDS analyses of the corrosion products of positions I and II in Figs.1c and f (atomic fraction / %)
在灭菌和接菌2种红壤环境中浸泡60 d去除腐蚀产物后X80管线钢表面的SEM像如图2所示。可以看出,灭菌环境中,试样表面沿划痕发生轻微的均匀腐蚀(图2a~c);存在SRB的环境中,试样表面呈严重的溃疡状腐蚀,腐蚀坑相互连接成孔洞(图2d~f)。接菌红壤中,试样表面可见选择性腐蚀,这与钢的微观组织有关,渗碳体(Fe3C)是钢中较为稳定的组织,而其周围的铁素体较为活泼,作为活性点电子更易于被SRB捕获而优先溶解腐蚀,Fe3C则残留在试样表面,SRB作用下管线钢的腐蚀明显严重。
图2 在灭菌和接菌2种红壤环境中浸泡60 d去除腐蚀产物后X80管线钢表面的SEM像
Fig.2 Surface SEM images of X80 steel after corrosion products removed after 60 d exposure in sterile (a~c) and SRB inoculated (d~f) red soils
接菌泥浆中细菌数量NSRB随时间的变化如图3所示。可见,SRB起始数量约为3000 cell/mL,前7 d数量呈现下降趋势,第7 d降低到最低约1100 cell/mL,此后7~15 d SRB进入指数生长期,第16 d数量达到40000 cell/mL的峰值。此后,随营养物质消耗,SRB数量开始下降,到40 d时,细菌数量稳定在1500 cell/mL左右。接菌红壤泥浆的起始pH值分别为4.6和4.3,接菌初期,SRB需要重新适应该环境,期间部分细菌可能无法适应该环境而死亡,导致前7 d细菌数量下降。
图3 硫酸盐还原菌(SRB)数量NSRB随时间变化的生长曲线
Fig.3 Growth curve of SRB amount NSRB with time
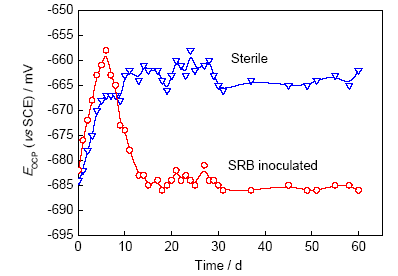
图4为X80管线钢在灭菌和接菌2种红壤环境中EOCP变化。可以看出,灭菌环境中,试样的EOCP在浸泡前5 d逐渐正移,这是由于X80管线钢试样表面腐蚀产物积聚所致,浸泡30 d左右时稳定在-660 mV附近;接菌红壤中,试样EOCP在前7 d上升明显,与灭菌红壤中相似,由于环境pH值低,前7 d为SRB的环境适应期,细菌数量较少,影响不明显,此后伴随着SRB的大量繁殖,细菌的影响显著加剧,接菌体系中试样腐蚀电位在浸泡第7 d之后迅速降低,在浸泡20 d左右稳定在-685 mV附近。
图4 灭菌和接菌2种红壤环境中X80管线钢开路电位EOCP随时间的变化曲线
Fig.4 Open circuit potential (EOCP) of X80 steel in the sterile and SRB inoculated red soils
浸泡前7 d,X80管线钢试样EOCP在接菌红壤中正移大于无菌红壤中,可能是由培养基中的有机质与金属阳离子在金属表面形成络合物导致[22],对体系造成暂时的保护作用。SRB铁呼吸作用促进了电子由试样向红壤中Fe(III)的转移,Fe2+析出导致试样表面电子富集,同时SRB生物膜具有电活性特征[23,24],导致接菌红壤中试样的EOCP比灭菌环境中低约25 mV左右。
X80管线钢试样在灭菌和接菌2种体系中线性极化电阻(RLPR)的变化规律如图5a所示。由图可见,无菌红壤中,随浸泡时间的延长RLPR逐渐升高,10 d后达到稳定值,此后略有升高;接菌体系中,前7 d试样的RLPR与无菌红壤相近,且有相同的变化规律,期间SRB对腐蚀电化学过程没有显著影响,此后随着SRB增殖,生理代谢活动增强,RLPR迅速降低,其对试样的腐蚀作用增强,浸泡15 d时随着细菌数量基本达到峰值,RLPR达到稳定值,此后略有降低。RLPR的变化规律与图4中EOCP变化相对应,接菌红壤中试样的稳定RLPR值远低于灭菌环境中。
图5 灭菌和接菌2种红壤环境中X80管线钢试样线性极化电阻RLPR及其倒数RLPR-1随时间的变化曲线
Fig.5 Linear polarization resistance RLPR (a) and RLPR-1 (b) of X80 steel in sterile and SRB inoculated red soils
由Stern-Geary方程icorr=BRLPR-1,其中,icorr为腐蚀电流密度,可表征腐蚀速率;B为常数。相同体系中B近似相等,腐蚀速率可由RLPR-1评价[25]。图5b为RLPR-1随时间的变化规律。前7 d,2种环境下试样的腐蚀速率基本相同,此后随SRB增殖,有菌红壤中试样的腐蚀速率逐增大,而无菌红壤中试样的腐蚀速率未见明显变化;实验结束时,有菌红壤中的腐蚀速率约为无菌红壤的2.8倍。可见,SRB对X80管线钢的腐蚀电化学过程具有明显促进作用。
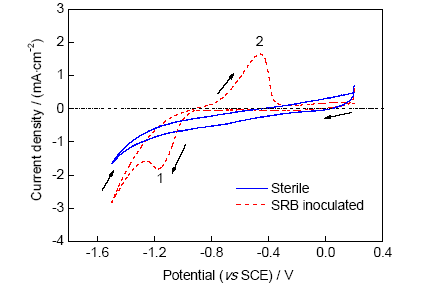
图6为X80管线钢在灭菌和接菌2种红壤中浸泡30 d测得的循环极化曲线。可见,在2种环境下X80管线钢都处于活性状态,电位回扫过程中的电流滞后效应说明阴极极化对试样产生了明显影响,接菌红壤中更为明显,主要是因为试样表面生成了一层致密的具有电活性的生物膜,在阴极极化过程中生物膜充电所致。极化曲线阳极分支线性不好,故只采用阴极分支对极化曲线进行拟合分析,由阴极Tafel外推方法[26]获得X80管线钢在无菌和接菌2种环境中的icorr分别为4.58和15.82 μA/cm2。
图6 X80管线钢在灭菌和接菌2种红壤环境中浸泡30 d后的循环极化曲线
Fig.6 Cyclic polarization plots of X80 steel after 30 d exposure in sterile and SRB inoculated red soils (icorr—corrosion current density)
玻碳电极在灭菌和接菌2中红壤中浸泡30 d测得的循环伏安曲线如图7所示。可以看出,接菌红壤中在-1.15和-0.5 V附近分别存在阴极还原峰1和阳极氧化峰2。阴极还原反应对应着红壤中Fe(III)的还原,-0.5 V处的氧化峰2为Fe(II)向Fe(III)的氧化;而灭菌红壤中,没有氧化还原峰出现,相应电流密度明显小于接菌土壤。SRB在X80管线钢表面生成电活性微生物膜,可以与基体进行电子交换[27]。SRB促进电子从钢基体到Fe(III)的转移,促进Fe(III)的还原(电流峰1),加剧了基体的腐蚀。还原产生的Fe(II)在峰2处被氧化。
图7 玻碳电极在灭菌和接菌2种红壤环境中浸泡30 d后的循环伏安曲线
Fig.7 Cyclic voltammetry plots (scan rate 5 mVs-1) measured on a glassy carbon electrode (area 0.07 cm2) after 30 d immersion in sterile and SRB inoculated red soils
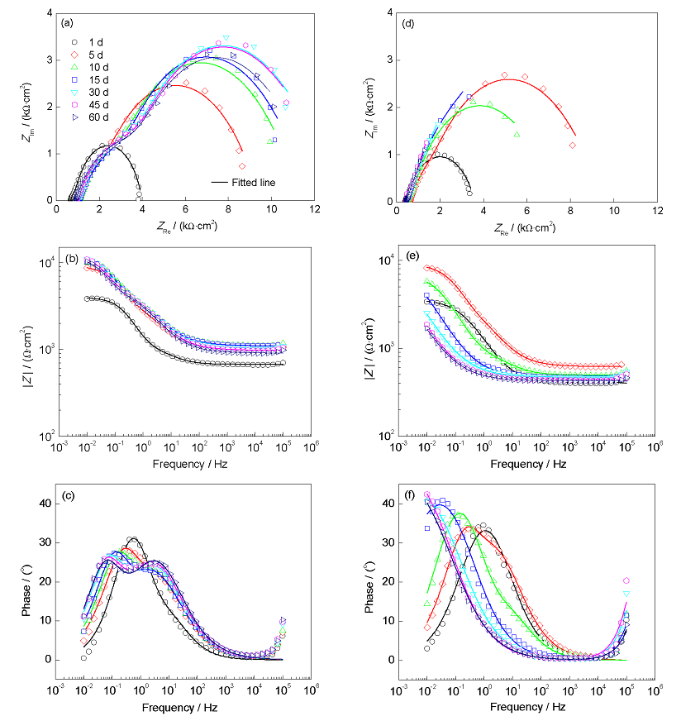
图8是X80管线钢试样在无菌和接菌红壤泥浆中的EIS。可以看出,在无菌红壤中,Nyquist图存在2个不完整的扁平容抗弧,高频端容抗弧较小,随浸泡时间延长,低频区容抗弧增大(图8a),阻抗|Z|逐渐增大(图8b)。图8c的EIS表现为2个时间常数,在低频区,随容抗弧增大,最大相位角逐渐增大,最大相位角对应的频率逐渐减小,Bode曲线向低频区移动,这是由试样表面逐渐积累的腐蚀产物膜所引起的。
图8 在灭菌和接菌2种红壤环境中浸泡不同时间后X80管线钢的电化学阻抗谱
Fig.8 Nyquist (a, d), Bode phase (b, e) and Bode impedance (c, f) plots of X80 pipeline steel after different times immersion in sterile (a~c) and SRB inoculated (d~f) red soils
接种SRB的环境中,实验前7 d,试样EIS的变化趋势与无菌红壤中一致,由于培养基和腐蚀产物膜等的影响,容抗弧逐渐增大;7 d后,SRB开始大量增殖,相应容抗弧开始变小(图8d),阻抗降低(图8e);Bode图中低频率阻抗与Faraday过程相关,与腐蚀电流(腐蚀速率)呈负相关。由图8e可以看出,最低频率处阻抗逐渐降低且始终比灭菌环境中低,反映出红壤中SRB对X80管线钢腐蚀过程的促进作用。图8f呈现2个时间常数,生物膜形成后最大相位角对应的频率向低频区移动更加明显,且移动幅度明显大于无菌红壤中,最大相位角也高于灭菌环境中,说明接菌红壤中金属/红壤界面发生了较大的变化,一般认为这样的移动是试样表面出现腐蚀的表现[28]。
由图8可见,Nyquist图存在2个不完整的扁平容抗弧(图8a和d),可归因于双电层(EDL)和生物膜/腐蚀产物膜对应的界面过程,扁平半圆弧是由于电极表面的弥散效应导致双电层充放电过程不均匀而产生的,因而用常相位元件Q代替电容元件C。由于生物膜和腐蚀产物的贡献无法区分,故这里2种环境中X80钢的阻抗谱都采用图9所示的等效电路Rs(Qf(Rf(QdlRct)))进行拟合分析,其中,Rs为土壤电阻,Rf是生物膜/腐蚀产物膜电阻,Qf是生物膜/腐蚀产物膜电容,Rct是双电层电荷转移电阻,Qdl是双电层电容。Qf和Qdl为常相位元件,其阻抗ZQ如下式[29,30]:
式中,Y0表示Q的大小;ω为角频率;n为弥散系数(0<n<1),n反映弥散效应强弱,n越小说明弥散效应越明显,n越接近1表明体系越接近理想电容。由图8可见,拟合结果与实验数据间的一致性良好,表明该等效电路适合于分析该腐蚀体系的EIS谱,拟合结果列于表2和3。
图9 用于EIS数据拟合的等效电路模型
Fig.9 Circuits model used to fit EIS data: Rs(Qf(Rf(QdlRct))) (Rs—soil resistance, Qf—corrosion product film capacitance, Rf—corrosion product film or biofilm resistance, Qdl—double electric layer capacitance, Rct—double electric layer resistance)
表2 灭菌土红壤中EIS拟合结果
Table 2 Fitting results of EIS in sterile red soil
表3 接菌土红壤中EIS拟合结果
Table 3 Fitting results of EIS in SRB inoculated red soil
对比X80管线钢在2种环境中的EIS及拟合分析结果可见,随埋藏时间延长,灭菌红壤体系的|Z|是一直增加的,主要是因为Rf增大所致,即试样表面腐蚀产物膜逐渐积累,其屏障作用减缓了腐蚀进程;接菌红壤中,浸泡7 d之后,最大相位角逐渐增大,最大相位角对应的频率逐渐减小,这是由试样表面逐渐积累的生物膜/腐蚀产物膜所引起,但是生物膜/腐蚀产物膜的出现并没有使腐蚀体系的|Z|增大,反而明显减小,EIS数据拟合结果显示Rf远小于无菌体系。EDS发现表面腐蚀产物中含有导电性良好的FeS,玻碳电极的循环伏安曲线验证了表面生物膜是电活性的,这种电活性生物膜/腐蚀产物膜减小了基体与腐蚀介质间的电子转移的阻力,致使总体体系阻抗减小。
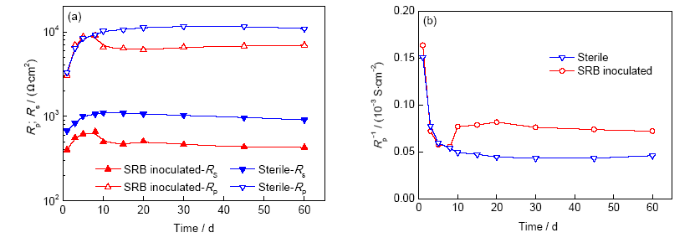
本工作中,金属/液膜界面双电层(电极电位)和腐蚀产物膜/生物膜是影响电极反应过程的状态变量。这种情况下,体系的极化电阻Rp可以由下式得到:
式中,ZF是体系的Faraday阻抗,即除去Rs和非Faraday阻抗ZNF后的阻抗。Rp-1可用于评价腐蚀速率[25],其不包含土壤电阻Rs,故比线性极化电阻RLPR更可靠。Rp和Rp-1随时间的变化如图10所示。可见,实验初期(前7 d)试样腐蚀速率较高,SRB的影响不明显,这与图4所示的开路电位变化规律相吻合;7 d后,SRB适应了酸性土壤环境,开始大量繁殖,腐蚀速率升高,30 d后逐渐达到平衡。灭菌环境中,由于腐蚀产物膜不断积累,腐蚀速率下降,浸泡20 d后达到稳定值。Rp和Rp-1随时间的变化与图5中线性极化电阻随时间变化规律一致。由Rp-1判断,接菌红壤中X80管线钢的腐蚀速率明显高于灭菌红壤,SRB对腐蚀过程促进作用显著。
图10 X80管线钢在灭菌和接菌2种红壤环境中的土壤电阻Rs、极化电阻Rp及Rp-1随时间的变化曲线
Fig.10 Rs, polarization resistance Rp (a) and Rp-1 (b) of X80 pipeline steel in sterile and SRB inoculated red soil environments
红壤是在热带和亚热带地区湿热气候条件下长期淋溶和脱硅富铁铝化风化作用下形成的,成土过程中,Si和可溶性盐基大量淋失,溶解度低的Fe2O3、FeOOH、Al2O3等氧化物发生相对积聚[17]。红壤质地黏重,黏土矿物以高岭石为主,氧化铁、氧化铝含量较高,Fe2O3质量分数为5%~10% (故土壤呈红色)[31]。红壤中氧化铁常以针铁矿(α-FeOOH)和赤铁矿(α-Fe2O3)等形式存在,它们是土壤的赋色成分,也是红壤中各种反应最活跃的因素,对红壤的表面电荷、吸附特性等理化性质具有深远影响[19,20],同时红壤的高腐蚀性也与其所含的Fe2O3矿物有关。红壤泥浆中,FeOOH、Fe2O3等铁氧化物通过作为阴极去极化剂促进钢的腐蚀过程[32]。本研究中,Rp-1值的比较表明接菌红壤中X80管线钢的腐蚀速率明显高于灭菌红壤中,SRB对腐蚀过程促进作用显著。
原始红壤泥浆的电阻率为125 Ω/m,加入培养基和SRB菌液的电阻率分别为20和18 Ω/m;实验结束后测得灭菌和接菌2种红壤环境中的电阻率分别变为11和5 Ω/m,可能是随着腐蚀反应的进行,X80钢的腐蚀及红壤中Fe(III)还原导致的Fe2+析出,使得土壤离子含量增加,导致土壤电阻下降,在SRB作用下电阻率的变化更为显著。图11为实验后无菌和接菌2种红壤土样宏观照片。可以看出,无菌红壤土壤仍保留其特有的红棕色,而在SRB作用下红壤颜色发生了变化,呈现黄褐色,这可能是土壤颗粒表面作为赋色成分的Fe(III)在SRB异化作用下还原为Fe(II)所致。长期淹渍缺氧的红壤环境中存在异化Fe(III) SRB,可使土壤胶体颗粒上的Fe(III)还原[33],导致土壤潜育化(gleying process),使土体颜色变为蓝灰色或青灰色[34,35]。
图11 实验结束后无菌和接菌2种红壤的土样照片
Fig.11 Appearances of the sterile red soil (a) and the SRB inoculated soil (b) after 60 d immersion
有研究[11,12,36,37]表明,SRB不止以硫酸盐作为终端电子受体,还可以还原多种类型的高价金属元素。其中,某些SRB菌株能够以高价态金属元素作为末端电子受体进行呼吸作用[38]。SRB胞外铁呼吸促发的Fe(III)的还原的具体过程尚不清晰,可能有2种机理:(1) 间接还原,即还原产物H2S可作为还原剂;(2) 直接酶促作用,在有机质贫瘠而Fe(III)丰富的环境中,SRB可利用H2、金属等作为电子供体,以Fe(III)作为末端电子受体,实现电子从金属至Fe(III)的转移[39,40]。
针对富Fe红壤而言,土质较为贫瘠,其中有机质及硫酸盐含量较少而富Fe黏土矿物含量较高[41]。在本实验中SRB可能同时使用双重机制还原黏土矿物,间接还原作用微弱,SRB主要通过直接酶促反应还原Fe(III)。该过程化学反应方程如下:
间接还原:
直接还原:
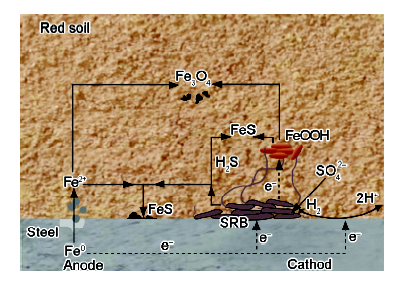
图12 含SRB红壤中管线钢腐蚀反应示意图
Fig.12 Schematic illustration of corrosion process of X80 steel in SRB inoculated red soil environment
图12所示为SRB与红壤中FeOOH的作用过程,以及各反应电子传递方向。
土壤环境中,SRB等微生物可在钢表面生成电活性生物膜,可在无外加介体情况下与基体进行电子交换[42]。自然环境中,微生物会选择电势最低且可用的电子供体,以最大化使能量增益,以进行新陈代谢;同样,也会选择电势最高且可用的电子受体获取能量增益,土壤中铁氧化物一般通过这种方式被微生物还原[43]。从热力学角度分析,Fe(III)还原比SO42-还原和甲烷化获得更多的能量[42],微生物异化还原Fe(III)应优先于SO42-还原过程[44]。在富Fe红壤中,由于硫酸盐含量较少,SRB主要通过直接酶促反应还原Fe(III)氧化物(公式(5)和(6))。SRB利用金属等作为电子供体,以Fe(III)作为末端电子受体,实现电子从X80管线钢至FeOOH的转移,这个反应中,SRB获得生命活动所需能量,并作为电子传输媒介促进了钢的腐蚀电化学过程[39,40]。红壤中有机物贫瘠,缺乏可溶态易利用的电子供体和受体,有些SRB在环境胁迫作用下能够产生导电的“纳米导线”[14],通过直接或间接方式从铁基体活性点处获得电子[15],并且将红壤中FeOOH、Fe2O3作为电子供体而还原(公式(6))[8]。相关过程如图12所示,该过程中,SRB作为电子传输媒介,参与Fe和Fe(III)间的电子转移,加速了X80管线钢的腐蚀电化学过程。
(1) 实验周期前7 d为SRB的环境适应期,期间SRB对腐蚀电化学过程没有显著影响。7 d后,SRB导致X80管线钢试样自然腐蚀电位降低25 mV左右,极化电阻显著降低,SRB显著促进了X80管线钢的腐蚀过程。随SRB的大量增殖,有菌红壤中试样的腐蚀速率逐渐增大,而无菌对照组红壤中试样的腐蚀速率未见明显变化;实验结束(60 d)时,根据线性极化电阻测试结果,有菌红壤中腐蚀速率约为无菌红壤中的2.8倍。
(2) 实验60 d后,接菌红壤失去了其特有的红棕色,转变为灰褐色,在SRB的异化还原FeOOH/Fe2O3等铁氧化物作用下,红壤的腐蚀性已经显著降低。
(3) SRB通过胞外铁呼吸可与红壤颗粒表层FeOOH/Fe2O3发生作用,引起FeOOH/Fe2O3的微生物异化还原,该过程中,SRB作为电子传输媒介,参与Fe和氧化铁间的电子转移,该过程是红壤SRB促进局部管线钢电化学腐蚀过程的主要原因。
 , 马健
, 马健
1 实验方法
2 实验结果
2.1 腐蚀形貌

Position
O
Al
Si
Fe
S
I
42.41
9.64
13.42
34.53
-
II
34.52
9.95
18.37
24.49
12.67

2.2 开路电位

2.3 线性极化行为

2.4 电化学极化

2.5 EIS

Time
Rs
Yf
nf
Rf
Ydl
ndl
Rct
d
Ωcm2
Ssncm-2
Ωcm2
Ssncm-2
Ωcm2
1
672.3
1.014×10-4
0.7892
485
1.638×10-4
0.8574
2823
5
1008.0
9.166×10-5
0.6360
3286
1.515×10-4
0.9000
5128
10
1106.0
8.815×10-5
0.6193
4340
2.138×10-4
0.9384
5827
15
1096.0
9.105×10-5
0.6096
4413
2.613×10-4
0.9487
6170
30
1028.0
8.345×10-5
0.6250
4596
3.791×10-4
0.8994
6995
45
967.2
8.799×10-5
0.6151
4860
4.594×10-4
0.9185
6732
60
906.4
8.177×10-5
0.6334
4324
5.172×10-4
0.8870
6563
Time
Rs
Yf
nf
Rf
Ydl
ndl
Rct
d
Ωcm2
Ssncm-2
Ωcm2
Ssncm-2
Ωcm2
1
399.4
1.321×10-4
0.7552
512
1.413×10-4
0.7853
2541
5
616.1
1.331×10-4
0.6525
3443
1.579×10-4
0.8977
5279
10
493.5
1.811×10-4
0.7243
440
3.971×10-4
0.7445
6052
15
466.1
6.576×10-4
0.7223
396
9.841×10-4
0.7988
5962
30
462.4
1.412×10-3
0.6871
542
1.712×10-3
0.7881
6025
45
433.6
2.391×10-3
0.6605
604
2.453×10-3
0.8748
6174
60
427.8
2.551×10-3
0.6863
652
3.471×10-3
0.8566
6292
3 分析讨论

4 结论
来源--金属学报






 沪公网安备31011202020290号
沪公网安备31011202020290号
