王鲁宁 ,1,2, 刘丽君1, 岩雨1,3, 杨坤1, 陆黎立1
,1,2, 刘丽君1, 岩雨1,3, 杨坤1, 陆黎立1
1.北京科技大学 材料科学与工程学院 北京材料基因工程高精尖创新中心 北京 100083
2.北京科技大学 新金属材料国家重点实验室 北京 100083
3.北京科技大学 新材料技术研究院 北京 100083
摘要
医用金属材料与体液接触时,蛋白质会快速吸附在其表面,并对材料的腐蚀行为产生影响。体外测试结果表明,蛋白质的吸附会减缓腐蚀;蛋白质-金属复合物脱离材料表面会加速腐蚀,如果沉积在材料表面,则会减缓腐蚀。蛋白质在金属材料表面的吸附及对腐蚀的影响与自身的种类和浓度、金属材料的性质等因素有关。目前,蛋白质吸附对医用金属材料腐蚀行为的影响尚未达成共识。蛋白质作为体液中重要的成分之一,体外测试中需要考虑其对医用金属材料腐蚀的影响,以便于明确体内外测试结果的差异和寻找合适的体外测试环境,这将有利于对医用金属材料在体内的腐蚀行为做出合理的预测。
关键词: 蛋白质 ; 医用金属材料 ; 腐蚀 ; 吸附 ; 体外测试
生物医用金属材料植入人体后,表面会与体液迅速发生一系列反应,包括腐蚀。腐蚀过程中释放的金属离子及形成的腐蚀产物会干扰周围细胞的行为,进而影响植入体周围组织的微环境[1]。腐蚀还会影响材料在体内的安全服役寿命。均匀腐蚀会使材料截面不断减少,但在达到材料断裂强度前仍可维持一定的力学性能,保持其支撑作用;而局部腐蚀会导致应力集中并引发疲劳断裂,具有突发性,会大大缩短材料的服役时间。因此,腐蚀行为是评价医用金属材料性能的标准之一。
研究生物医用材料降解性能最理想的方法是动物体内实验,然而较高的测试成本和有限的测试数量,使得体外测试成为初始研究阶段不可缺少的部分。但是,体外测试结果能否作为预测体内降解的可靠依据仍需探讨。以镁合金为例,Sanchez等[2]比较了2015年之前体内外测试中镁合金的腐蚀速率,本文作者总结了近两年关于镁合金的部分研究数据(表1[3~7]),在考虑实验条件(测试方法、时间、溶液等)差异的情况下,将同一种材料的腐蚀速率加和后计算得到平均值,进行对比(图1)。结果表明,相同的镁合金材料在体内外测试中的腐蚀速率存在或多或少的差异。因此,体外测试结果并不能完全作为体内降解行为的推断依据。目前,体外测试方法尚不完善[8, 9],研究中有必要关注以下问题:(1) 改进体外测试模型,尽可能地模拟体内环境;(2) 确定造成体内外腐蚀差异的因素;(3) 确定金属材料在体内的降解模型。但是,实时监测金属材料在体内的腐蚀具有一定的难度[2]。因此,需要尽可能改进体外测试方法,并找出体内外测试差异的原因。
表1 Mg及镁合金体内外测试中的腐蚀速率[3~7] (mm/a, unless otherwise indicated)
Table 1 The in vitro and in vivo corrosion rates of Mg and Mg alloys[3-7]
|
Material
|
In vitro
|
In vivo
|
Ref.
|
|
|
|
|
Solution
|
Weight loss
|
Hydrogen evolution
|
Volume reductions/
|
|
|
|
|
|
|
|
weight loss
|
|
Pure Mg
|
PBS
|
0.28±0.07
|
0.19±0.02
|
0.15±0.03
|
[3]
|
|
|
HBSS
|
0.72±0.31
|
0.57±0.07
|
|
|
|
|
DMEM
|
1.07±0.10
|
0.57±0.07
|
|
|
|
Mg-10Gd
|
PBS
|
0.61±0.10
|
0.40±0.10
|
1.11±0.05
|
[3]
|
|
|
HBSS
|
1.57±0.62
|
1.23±0.56
|
|
|
|
|
DMEM
|
0.42±0.12
|
0.20±0.01
|
|
|
|
Mg-2Ag
|
PBS
|
16.71±3.06
|
15.12±2.97
|
0.13±0.04
|
[3]
|
|
|
HBSS
|
5.41±0.71
|
3.48±0.36
|
|
|
|
|
DMEM
|
2.21±0.26
|
0.68±0.04
|
|
|
|
Pure Mg
|
DMEM
|
Static immersion 1.6±0.3
Aortic bioreactor:
Lumen>4.0±0.8
Wall 1.9±0.5
|
|
Aortic lumen 1.1±0.3
|
[4]
|
|
|
|
|
Aortic wall 1.5±0.6
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Mg-2Sr
|
HBSS
|
~0.37
|
~0.32
|
1.37
|
[5]
|
|
Mg-2Sr-Ca
|
HBSS
|
~0.24
|
~0.21
|
1.10
|
[5]
|
|
Mg-2Sr-Zn
|
HBSS
|
~0.15
|
~0.11
|
0.85
|
[5]
|
|
Pure Mg
|
HBSS
|
17.2%±0.5% (14 d)
|
|
65.4%±1.5% (4 weeks)
|
[6]
|
|
Mg+Ca-Sr-P coating
|
HBSS
|
4.8%±0.7% (14 d)
|
|
76.7%±1.9% (4 weeks)
|
[6]
|
|
Mg-30%Sc (mass fraction)
|
HBSS
|
|
α+β phase 3.4±0.1
|
β phase 0.06±0.01
|
[7]
|
|
|
|
|
Single phase 2.9±0.1
|
|
|
Note: PBS—phosphate buffered saline, HBSS—Hank??s balanced salt solution, DMEM—Dulbecco??s modified Eagle medium
新窗口打开| 下载CSV
图1
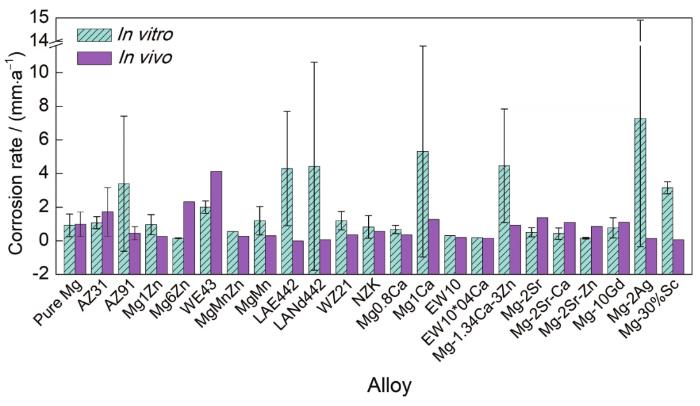
图1 体内外测试中镁合金腐蚀速率的对比(少于3组数据所得的条形图无误差棒)
Fig.1 Comparisons of in vivo and in vitro corrosion rates of magnesium alloys (The columns without error bars are obtained from less than three sets of data)
一般来说,影响金属植入体降解的因素主要有2个:一是材料特性,如成分、加工过程、表面性质和形状设计等;二是所处的生理环境,如大量的离子(如Na+、K+、Ca2+、Mg2+、HCO、Cl-、HPO、SO等)、有机分子和细胞等物质,以及局部环境的pH值、温度和含氧量等。生物体环境的复杂性增加了预测或确定金属材料腐蚀行为的难度,在不同的模拟体液中,相同金属材料的腐蚀速率也会存在很大的差异[3]。体外测试中,常用的模拟体液(表2[3,10~15])的无机成分接近其在生物体中的真实含量[10,11],而氨基酸、蛋白质、维生素、多糖、细胞等有机成分经常被忽略[3,11~15]。但是,在E-MEM (Eagle??s minimum essential medium)、DMEM (Dulbecco??s modified Eagle medium)和胎牛血清(fetal bovine serum,FBS)等几种典型的细胞培养基中,几种金属材料(如纯Mg、Mg-Dy)的腐蚀速率会受到氨基酸、多糖的影响[16~18];也有研究证实了蛋白质、多糖及细胞可以影响金属材料的腐蚀行为[19~25]。这些发现促使研究者们越来越关注蛋白质等有机成分在医用金属材料降解过程中的作用。
表2 血浆、关节滑液、几种常用模拟体液和模拟血浆的主要化学成分[3,10~15]
Table 2 Chemical components of blood plasma, synovia fluids, several commonly used simulated body fluids and simulated blood plasma[3,10-15]
|
Fluid
|
Na+
|
K+
|
Ca2+
|
Mg2+
|
Cl-
|
HCO
|
HPO
|
H2PO
|
SO
|
|
|
mmol·L-1
|
mmol·L-1
|
mmol·L-1
|
mmol·L-1
|
mmol·L-1
|
mmol·L-1
|
mmol·L-1
|
mmol·L-1
|
mmol·L-1
|
|
Blood plasma[10,13]
|
134-143
|
3.5-4.7
|
2.1-2.7
|
1.5
|
100-108
|
25-30
|
1.0
|
-
|
0.5
|
|
Synovia fluids[10]
|
133-139
|
3.5-4.5
|
1.2-2.4
|
|
87-138
|
-
|
-
|
-
|
|
|
SBF[15]
|
142.0
|
5.0
|
2.5
|
1.5
|
148.0
|
4.2
|
1.0
|
-
|
0.5
|
|
PBS[3]
|
154.1
|
4.1
|
-
|
-
|
140.6
|
-
|
8.1
|
1.5
|
-
|
|
HBSS[3,12]
|
142.8
|
5.8
|
2.5
|
0.8
|
143.3
|
4.2
|
0.3
|
0.4
|
0.8
|
|
DMEM[3,12]
|
155.3
|
5.3
|
1.8
|
0.8
|
115.7
|
44.1
|
0.9
|
-
|
0.8
|
|
Ringer??s[14]
|
147
|
4.1
|
4.3
|
-
|
160
|
-
|
-
|
-
|
-
|
|
SBP[11]
|
142.0
|
5.0
|
2.5
|
1.5
|
103.0
|
27.0
|
1.0
|
-
|
0.5
|
|
Fluid
|
Amino acids
|
Glucose
|
Uric acid
|
Vitamins
|
Phenol red
|
Albumin
|
IgG
|
Fibrinogen
|
|
|
g·L-1
|
g·L-1
|
g·L-1
|
|
|
g·L-1
|
g·L-1
|
g·L-1
|
|
Blood plasma[10,13]
|
20-51
|
650-966
|
30.5-70.7
|
-
|
-
|
37.6-54.9
|
6.4-13.5
|
2-4
|
|
Synovia fluids[10]
|
-
|
-
|
39
|
-
|
|
6-10
|
1.47-4.62
|
-
|
|
SBF[15]
|
-
|
-
|
|
-
|
-
|
|
|
|
|
PBS[3]
|
-
|
-
|
|
-
|
-
|
|
|
|
|
HBSS[3,12]
|
-
|
5.6
|
|
-
|
-
|
|
|
|
|
DMEM[3,12]
|
10.6
|
25.0
|
|
0.15
|
0.04
|
|
|
|
|
Ringer??s[14]
|
-
|
-
|
|
-
|
-
|
|
|
|
|
SBP[11]
|
-
|
-
|
|
-
|
-
|
|
|
|
Note: SBF—simulated body fluid, SBP—simulated blood plasma
新窗口打开| 下载CSV
生物体内,蛋白质是尺寸相对较大的生物分子,并且有聚集在液体/固体界面的趋势。蛋白质在植入体表面的吸附不仅与细胞黏附、排异反应等生理活动有关,也会改变材料的腐蚀行为——腐蚀速率的加快或降低、腐蚀模式的改变等[26~28]。1982年,Clark和Williams[29]研究了生理盐水中蛋白质对金属单质粉末(尺寸为10~100 μm)腐蚀的影响。如表3[29]所示,牛血清白蛋白(bovine serum albumin,BSA)和纤维蛋白(fibrinogen, Fg)都会加速Cr粉、Ni粉、Cu粉和Co粉的溶解,对Ti粉和Al粉的溶解几乎无影响,但是会减缓Mo粉的溶解。这一工作为如何选择合适的溶液成分进行医用金属材料的体外测试提供了指导意义,并特别指出蛋白质应作为体外测试溶液中的重要组成部分。因此,明确蛋白质在金属材料表面的吸附以及对材料腐蚀的影响,将有助于减小体内外测试结果的差异,从而寻找更加适合医用金属材料的体外测试环境,对金属植入体的体内降解行为做出合理的预测。
表3 金属粉末在生理盐水和含有蛋白质的溶液中浸泡16 h后,金属离子的释放量[29] (10-6)
Table 3 Analyses of metals in saline and protein solutions after 16 h exposure[29]
|
Metal
|
Saline
|
Albumin
|
Fibrinogen
|
|
Aluminum
|
1.30
|
1.48
|
1.00
|
|
Chromium
|
0.50
|
2.38
|
0.70
|
|
Cobalt
|
1.50
|
31.50
|
40.95
|
|
Copper
|
3.72
|
169
|
96.60
|
|
Molybdenum
|
514
|
390
|
355
|
|
Nickel
|
4.80
|
7.70
|
9.50
|
|
Titanium
|
0.2
|
0.2
|
0.2
|
新窗口打开| 下载CSV
1 蛋白质在医用金属材料表面的吸附
1.1 蛋白质在医用金属材料表面的吸附机理
血浆中主要的蛋白质有白蛋白、球蛋白和纤维蛋白。其中,白蛋白的浓度最高(约60%),并且对蛋白质的初始吸附起到重要作用[10,30]。人体血清蛋白(human serum albumin,HSA)包含585个氨基酸,17个二硫键,一个自由的巯基—SH和一个色氨酸,具有良好的配体结合性能[31]。体外测试中,BSA被广泛用于模拟体内蛋白质。BSA与HSA的结构相似(图2),一级结构包含3个部分(I、II、III),每部分又包含2个螺旋结构(A和B)。BSA的等电点为4.7~5.2,在中性环境条件下,氨基酸中的—COOH失去质子,使BSA分子带负电荷。以下以BSA为例,综述蛋白质在金属表面的吸附及其对腐蚀行为的影响。
图2

图2 牛血清白蛋白(BSA,PDB bank:4f5s)的结构示意图
Fig.2 Schematic of BSA (PDB bank: 4f5s) structure (BSA—bovine serum albumin)
蛋白质在金属表面的吸附主要通过疏水作用、van der Waals力、静电吸引、共价键等方式[32~34]。研究[35]发现,在醋酸钠溶液中,BSA通过水合作用、静电吸引作用与TiO2表面结合,低浓度BSA在吸附过程中可能会发生构象改变。对于CoCrMo合金[36],表面不带电时,疏水作用控制BSA的吸附过程,并且BSA分子侧向吸附在表面,形成单分子层。而当表面带正电荷时,静电吸引对BSA的吸附起主导作用,BSA的最大吸附量发生在等电点。也有研究[29]指出,BSA内部的二硫键具有催化作用,也会促使分子与金属表面结合。二硫键会被金属还原,形成蛋白质-金属络合物,之后二硫键被O2氧化,这一过程的不断重复导致了蛋白质的交联和沉积。分子动力学模拟(MD)为分子水平上对蛋白质吸附机理的认识提供了可能[37,38]。以BSA为例[39],利用Materials Studio模拟可得知,BSA通过氨基酸中—CH3吸附在疏水表面,—COOH则参与亲水表面的反应(图3[39])。
图3

图3 分子动力学模拟BSA在2种表面吸附后的优化构型[39]
Fig.3 Optimized complexes of BSA on polystyrene (PS) surface (a) and BSA on the GeO2 surface (b)[39]
1.2 蛋白质在医用金属材料表面吸附的影响因素
蛋白质在金属表面的吸附受多种因素的影响[40,41],不同类型的蛋白质、不同的金属材料以及不同的溶液pH值都会导致蛋白质的吸附结果不同。Lundin等[42]利用石英晶体微天平(quartz crystal microbalance,QCM)研究了不同类型的蛋白质(如表4[42]所示)在316L不锈钢表面的吸附。溶液pH=4时,316L表面带正电荷,pH=7.4时则带负电荷。2种pH值条件下,牛颌下腺粘蛋白(submaxillary gland mucim,BSM)都带负电荷。从静电吸引角度看,pH=4时BSM的吸附量更高。此时,HSA和Cr表面都带正电荷,相同电荷的排斥作用会减少HSA的吸附量。但是结果表明,由于HSA的羧基和不锈钢表面的Cr(III)氢氧化物之间形成了很强的共价键,HSA的吸附量仍然较高。白蛋白和粘蛋白的内部构象稳定性低,在金属表面的吸附与静电吸引作用无关,因此在316L表面的吸附与溶液pH值无关。溶菌酶(lysozyme,LYS)具有较高的内部构象稳定性,一般不会吸附在带有相同电荷的亲水表面。因此,pH=4时,LYS在316L表面的吸附量较少。在Wagener等[43]的研究中,BSA和LYS在Mg和Fe表面的吸附均与静电吸引作用有关。中性条件下,带负电的BSA在MgO/Mg(OH)2表面的吸附量较高,而带正电荷的LYS则在带负电的铁表面吸附较多(图4)。
表4 不同蛋白质的结构、尺寸、分子量及等电点[42]
Table 4 The structure, size, molecular weight, and isoelectric point of different kinds of proteins[42]
|
Protein
|
Structure
|
Size
|
Molecular weight
|
Isoelectric point
|
|
Human serum albumin (HSA)
|
Triangular
|
8 nm×8 nm×3 nm
|
66 KDa
|
4.7
|
|
BSA
|
Triangular
|
8 nm×8 nm×3 nm
|
66 KDa
|
4.7
|
|
Bovine submaxillary gland mucin (BSM)
|
Random coil
|
Radius of 130 nm
|
7 MDa
|
3
|
|
Lysozyme (LYS)
|
Globular
|
4.5 nm×3 nm×3 nm
|
14.1 KDa
|
11
|
新窗口打开| 下载CSV
图4
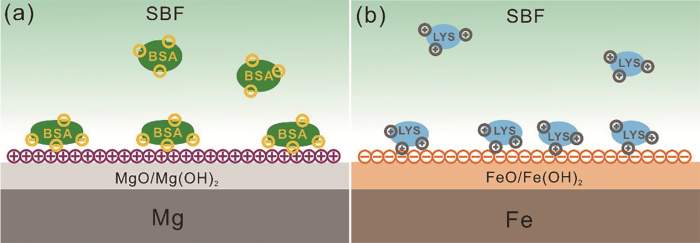
图4 在模拟体液中,蛋白质通过静电吸引作用吸附在材料表面
(a) BSA adsorbs on Mg surface with positive charges
(b) LYS adsorbs on Fe surface with negative charges
Fig.4 Protein adsorption on the materials in SBF
当金属表面带有特定官能团或亲水性不同时,蛋白质的吸附状况也不相同。Roach等[44]利用石英晶体天平和掠射角红外光谱研究了BSA和Fg在亲水(含有—OH)、疏水(—CH3)表面的吸附情况。BSA在疏水表面的结合常数高于亲水表面(表5[44]),但是分子结构的有序程度降低,在材料表面的覆盖率也降低。因此,测试结果显示BSA在亲水表面的吸附量反而更高。与BSA相比,Fg会更快速地吸附在2种表面。2种蛋白质都会在1 h内快速吸附在2种表面,之后由吸附引起的构象改变便会减少。另外,在研究的浓度范围内,BSA在材料表面的吸附只有一个过程,但是Fg在浓度高于0.5 mg/mL时会发生多级吸附:初始阶段,Fg分子长轴平行于材料表面;之后由于表面吸附位点减少,分子之间的疏水作用导致吸附的Fg分子发生重排,长轴垂直于表面,以便更多的分子吸附在表面。
表5 BSA和纤维蛋白在材料表面的结合常数和吸附饱和值[44]
Table 5 Binding constants and saturation values for BSA and Fg[44]
|
Material
|
Binding constant
|
Saturation value
Hz
|
|
BSA OHa
|
5.3
|
47.2
|
|
BSA CH3a
|
5.4
|
40.9
|
|
Fg OH
|
10.9
|
102.0
|
|
Fg CH3
|
36.0
|
92.6
|
Note:a—OH and CH3 represent hydrophilic and hydrophobic surfaces, respectively; Fg—fibrinogen
新窗口打开| 下载CSV
在研究蛋白质在镁合金表面的吸附时发现,纯Mg和AZ61表面的接触角为60°时,BSA吸附量较高,Fg的吸附量较少。而在AZ80表面(接触角约60°),2种蛋白质的吸附量都很少。AZ31表面接触角约40°,BSA在其表面的吸附量却比在纯Mg表面高[45]。这一结果说明,除了表面亲水性外,金属材料的成分也会对蛋白质的吸附产生影响。
除此之外,蛋白质所处的液体环境也会影响其吸附行为。Pradier等[46]发现溶液中的Na+促进BSA吸附的作用不明显;Mg2+可起到连接作用(图5[46]),提高BSA在不锈钢表面的吸附量,并使BSA的构象发生变化;但同样是正二价的Ca2+,其对BSA的吸附几乎没有影响。研究人员推测这是由于Ca2+尺寸远大于Mg2+ (离子半径:Ca2+=0.114 nm,Mg2+=0.086 nm),Mg2+更容易进入BSA结构中。但是,有研究[47]证实了BSA与Ca2+之间存在静电吸引作用,并且会促使BSA吸附在CaP盐表面。此外,前一项研究中Ca2+和Mg2+的浓度并不相同,需要进一步证实其推断。中性条件下,BSA表面带有负电荷,会与溶液中的阴离子,如Cl-、PO等发生竞争吸附。研究[48]表明,在CoCrMo合金表面,磷酸盐缓冲液(phosphate buffered saline,PBS)中的PO优先占据表面的活性位点,阻碍BSA的吸附,这也导致BSA的添加对腐蚀几乎没有影响。
图5
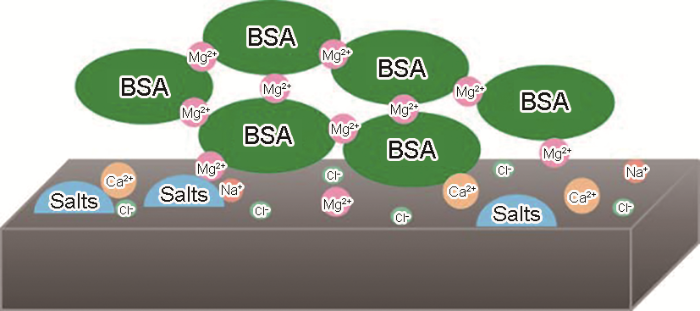
图5 模拟海水环境中,BSA在不锈钢表面的吸附模型图:BSA先是牢固地吸附在氧化层上,溶液中的Mg2+与之连接,促使第二层BSA吸附[46]
Fig.5 Schematic model of the BSA layer formed on stainless-steel surface in artificial seawater, showing a first organic layer strongly attached to the oxide surface, and a second layer of proteins, the cohesion of which is ensured by magnesium ions[46]
综上所述,蛋白质的吸附与金属的表面性质、蛋白质的特性以及溶液条件有关。一种或多种因素的不同都会影响到蛋白质与金属表面的结合,进而影响到金属材料的腐蚀或离子释放。
2 蛋白质的吸附对医用金属材料体外腐蚀的影响
研究[36]指出,BSA吸附在CoCrMo表面时会降低表面电势(图6a~d[36])。因为BSA会促进金属原子中自由电子的逃逸,使其聚集在表面,导致金属材料表面的电势降低,使腐蚀更容易发生(图6e[36])。但在体外测试中,对于不同的金属材料,蛋白质在表面的吸附对腐蚀的影响却存在着差异。本部分主要通过金属材料腐蚀速率的改变以及腐蚀产物和腐蚀方式的改变来综述蛋白质的吸附在材料腐蚀过程中的作用。
图6
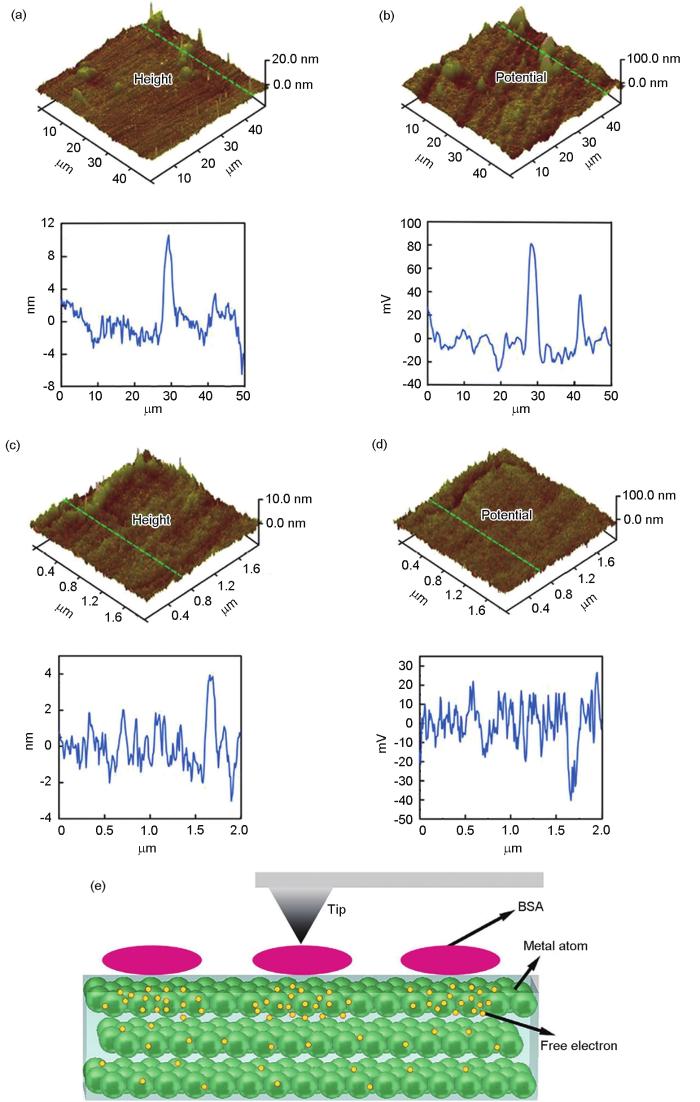
图6 CoCrMo合金表面及BSA吸附在CoCrMo合金表面后的AFM形貌图和对应的扫描Kelvin探针测量的电势图,每张图下的曲线表示图中绿线位置的形貌起伏和电势变化,以及BSA在CoCrMo表面吸附后,诱导表面电子聚集的示意图[36]
Fig.6 AFM topographic images (a, c) and SKPFM images (b, d) of the CoCrMo alloy surface (a, b), and BSA on the CoCrMo alloy surface (c, d), the curves under each figure show the ups and downs of morphology and the potential of the green line on the corresponding image; and schematic of the adsorption of BSA on the CoCrMo surface which induces the gathering of free electros under SKPFM (e)(AFM—atomic force microscope, SKPFM—surface Kelvin potential force microscopy)[36]
2.1 蛋白质对惰性医用金属材料体外腐蚀行为的影响
惰性医用金属材料主要是不锈钢、Co-Cr合金和钛合金。其表面的氧化膜可提高材料的耐蚀性能,但蛋白质存在时,氧化物对材料的保护作用会受到影响。
不锈钢[49]和钛合金[50]是临床应用较早的金属材料,作为骨植入体和牙种植体,会在体内微环境中受到摩擦磨损,体外测试中经常对比它们在静态和摩擦状态下的腐蚀。在生理盐水中,添加BSA加速了316L和纯Ti在静态时的腐蚀,对Ti-6Al-4V无影响;而在磨损实验中,BSA减缓了316L的腐蚀,对纯Ti和Ti-6Al-4V无影响[51]。当生理盐水中含有H2O2时,BSA与H2O2的协同作用会进一步加速316L表面氧化物的溶解,促进点蚀生成[52]。在Ringer??s溶液中,BSA同样会加速316L的点蚀[53]。但是如果在PBS中添加BSA,316L的腐蚀几乎不受影响[54],却会加快奥氏体低碳不锈钢的溶解速率[32],也会促进不锈钢304、430中铁、铬、镍和锰离子的释放。
对于金属Ti,在PBS中加入BSA会阻碍钛合金(Ti-6Al-4V、Ti-13Nb-13Zr、Ti-6Al-7Nb)的再钝化过程,促进金属离子的释放,并且降低表面氧化物的硬度[55],但是对纯Ti的影响较小[26]。而在含F-的生理盐水中,BSA会减小纯Ti的腐蚀速率[56]。同种溶液中,BSA也会减缓Ti-6Al-4V的腐蚀;但在不含F-的溶液中,BSA对钛合金的腐蚀几乎没有影响[57]。因此推断,BSA会阻碍F-对Ti的破坏。而在含有H2O2的生理盐水中,BSA与H2O2的协同作用会加速钛离子的释放[58]。在成分较为复杂的模拟血浆(SBP)中,BSA促进Ti-6Al-4V的腐蚀,与钛合金表面的钝化膜之间存在相互作用[59]。如果将材料置于磨损状态,10%FBS会减缓钛合金(Ti-6Al-4V、Ti-13Nb-13Zr、Ti-6Al-7Nb)在PBS中的腐蚀[60]。但是在SBP中,BSA没有改变摩擦状态下Ti-6Al-4V的腐蚀[61]。
CoCrMo合金也是外科手术中应用较多的惰性金属材料,其表面的钝化膜对腐蚀有较大的影响。在PBS中,CoCrMo钝化时间小于1 h时,加入BSA后开路电位(OCP)迅速降低,然后缓慢上升;延长钝化时间后,OCP值下降幅度变小。因此推断,钝化时间越长,合金表面钝化膜越稳定,BSA对其稳定性和溶解速率的影响越小[62]。Yan等[63]则证实,在PBS中加入BSA会加速CoCrMo的腐蚀。而在磨损实验中,BSA与合金表面形成的复合膜会起到润滑作用,并减缓材料的摩擦腐蚀。之前的研究[64]有类似的发现,在0.36%NaCl中添加50%FBS会加速CoCrMo及316L中金属离子的释放;在磨损状态下,血清在材料表面形成保护膜层,减缓腐蚀。该研究组[65]还发现,从阴极电位增加至阳极电位,BSA在CoCrMo表面的吸附量减少,膜层厚度和覆盖率都减少,导致材料表面摩擦系数增大,剪切应力增加。因此,BSA的吸附还与合金次表面的变形程度有关。
此外,Karimi等[66~68]同时对316L、CoCrMo和Ti-6Al-4V合金的腐蚀行为做了一系列研究。结果发现,低浓度的BSA增加了316L和CoCrMo表面钝化膜的稳定性,抑制阴极反应(图7a和b[66]);较高浓度BSA增加了Ti-6Al-4V合金的稳定性,抑制阳极反应,对阴极反应无明显影响(图7c[66])。在PBS中,HSA对3种材料腐蚀行为的影响与BSA相似,只是BSA的影响更明显。HSA可与表面氧化物中的Fe、Co结合,增加氧化物的稳定性,减少离子扩散,减缓腐蚀;钛合金则通过羟基质子与HSA连接,从而减缓腐蚀[69]。
图7

图7 PBS中添加不同浓度BSA (0~4 g/L)时,316L[66]、CoCrMo[66]、Ti-6Al-4V[66]和纯Zr[28]的动电位极化曲线
Fig.7 Potentiodynamic polarization curves of 316L[66] (a), CoCrMo[66] (b), Ti-6Al-4V[66] (c), and pure Zr[28] (d) in PBS solutions with various BSA concentrations (0-4 g/L) (E—potential, I—current density)
在对其他惰性金属材料的研究[70]中发现,PBS中加入BSA后,Nb的耐蚀性能随BSA浓度增加先提高再减弱。浸泡初期,BSA会增加Nb的阻抗;浸泡时间延长,BSA对阻抗的影响减弱。BSA对纯Zr腐蚀的影响如图7d[28]所示,在0~4 g/L范围内,BSA浓度升高会促进Zr的阳极溶解,而抑制阴极的反应。浸泡时间为1~12 h时,BSA会减缓纯Zr的腐蚀,时间延长则会加速腐蚀[28]。
2.2 蛋白质对可降解医用金属材料体外腐蚀行为的影响
目前,可降解金属材料主要有铁基、镁基和锌基材料[71,72]。镁合金由于良好的生物相容性,受到的关注较多。本部分主要以Mg及镁合金为例,探讨蛋白质对可降解医用金属材料腐蚀行为的影响。
体外测试中使用的盐溶液从成分单一的生理盐水到接近血浆成分的SBF (表1[3~7]),蛋白质的添加都会一定程度上影响材料的腐蚀行为。在0.9%NaCl中,BSA相当于阴极抑制剂,减缓Mg-Ca合金的腐蚀,并且BSA浓度越高,抑制作用越明显[73]。相同浓度的NaCl溶液中,BSA浓度为1 g/L时会加速纯Mg腐蚀,10 g/L却减缓腐蚀;增加NaCl浓度则会减弱BSA (10 g/L)对腐蚀的抑制作用[74]。但是在PBS中,10 g/L BSA会在镁(纯Mg、AZ31和LAE442)表面形成不稳定的、多孔的蛋白质层,加速腐蚀[20]。若是在SBF中,同样浓度的BSA对纯Mg产生的影响则与时间有关:3 h内减缓腐蚀,24 h时加速腐蚀[43]。如果改变BSA的浓度,其对腐蚀行为的影响也会改变。10和20 g/L的BSA会吸附在AZ80镁合金表面,减缓其腐蚀;而5和40 g/L BSA与基体发生螯合或自身聚集,加速镁合金溶解[11]。在SBF中增加BSA的浓度至40 g/L时,Mg-Mn合金(M1A)的腐蚀速率也会随浸泡时间延长而先减缓后增加[15],并且BSA会吸附在点蚀区域,促进镁合金均匀腐蚀(图8[15])。若是在SBF中添加的BSA浓度较低(0.01和0.1 g/L),它会减小AZ91镁合金的腐蚀速率[75]。但是,如果将AZ91浸泡在Hank??s平衡盐溶液(HBSS)中[76],40 g/L的BSA则会促使表面发生点蚀,并且加速应力腐蚀开裂。BSA浓度为20和40 g/L时,对ZK21-0.2Sc合金的腐蚀有类似的影响[77]。
图8
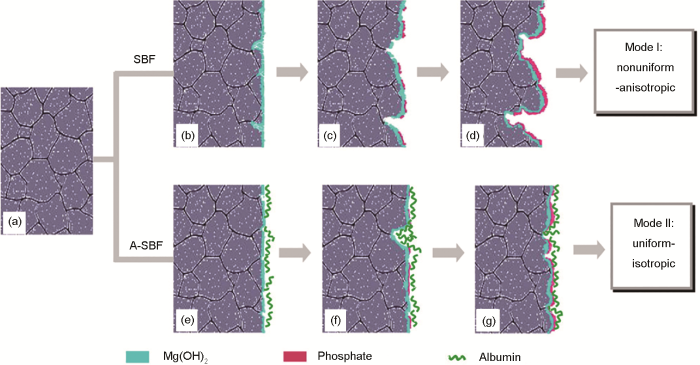
图8 M1A镁合金在SBF和含有BSA的SBF (A-SBF)中的腐蚀模型[15]
(a) M1A sample (b-d) M1A suffered pitting corrosion in SBF (e-g) BSA adsorption protected the M1A from pitting corrosion in A-SBF
Fig.8 Schematic illustrations of corrosion behaviors of M1A alloy in SBF and BSA-containing SBF (A-SBF)[15]
细胞培养基和FBS中包含白蛋白、氨基酸等有机成分,也经常被用作体外测试溶液。研究[78]表明,纯Mg在以下几种介质中的腐蚀速率从大到小排序为:NaCl+HEPES (N-2-hydroxyethylpiperazine-N'-2-ethane sulfonic acid)>NaCl>NaCl+NaHCO3>E-MEM>Earle(+) (Earle??s solution containing calcium and magnesium salts)>E-MEM+FBS。由此看出,培养基中的有机成分会减缓材料的腐蚀,与FBS的协同作用使减缓效果更加明显。在细胞培养基M199中加入FBS后,Mg-Nd-Zn-Zr镁合金的点蚀减轻,腐蚀速率减缓[19]。同样地,在细胞培养基DMEM中加入20%FBS后,纯Mg的腐蚀速率减小,但是FBS阻碍了Ca-P盐的沉积[17]。当FBS浓度为10%时,同样会增加材料表面的电荷转移电阻和膜层电阻,减缓WE43镁合金的腐蚀[79],减轻高纯Mg表面的点蚀,降低腐蚀速率;但是蛋白质与金属离子、氧化物之间的螯合作用会促进MgY合金的电偶腐蚀[80],加速Mg-Zn-Zr合金的腐蚀[81]。Willumeit等[82]对比了DMEM和HBSS中加入FBS前后,纯Mg的腐蚀行为以及表面腐蚀产物的变化。氨基酸、蛋白质导致无机成分的腐蚀层厚度减小,并形成有机膜层。但是这一膜层不够致密,无法有效阻碍腐蚀介质侵入基体,因此加速了纯Mg的腐蚀。
另外,对可降解锌的体外测试中发现,在含有60 g/L BSA的模拟血浆[83]和SBF[84]中,纯Zn的腐蚀行为相差较大:在SBF中,纯Zn表面的腐蚀产物主要是Ca/Zn-P盐,腐蚀层厚度约2 μm;但是在模拟血浆中,BSA会阻碍Ca-P盐沉积,腐蚀产物中只有蛋白质和ZnO/Zn(OH)2的复合物。从腐蚀速率来看,溶液中添加BSA会极大地减缓纯Zn的腐蚀,腐蚀速率的变化规律也发生了极大改变。
综上,对本文所涉及的静态实验结果进行了统计分析,统计中只考虑了材料、模拟体液和时间3个变量对结果的影响,结果如表6所示。在不同的体外测试溶液中,蛋白质会对同一种材料的腐蚀速率产生不同的影响,如纯Mg、纯Ti和Ti-6Al-4V;而在同一种溶液中(如PBS),蛋白质对不同金属材料的影响也会不同,可能加速、减缓或无影响;甚至在溶液相同、材料相同的条件下,不同实验组的结果中蛋白质对腐蚀速率的影响依然存在差异。因此,蛋白质对医用金属材料腐蚀速率的影响尚未有一致的结论。另外,从统计的数据中可看出,体外测试中的大部分情况下蛋白质会对材料的腐蚀速率产生影响。这一结果再次证明了蛋白质在体外测试中的重要性。
表6 体外测试中,不同溶液中添加蛋白质对医用金属材料腐蚀速率的影响
Table 6 The effects of BSA on the in vitro corrosion rate of biomedical metals in different solutions
|
Material
|
NaCl
|
NaCl+NaF
|
NaCl+H2O2
|
PBS
|
HBSS
|
SBF
|
Ringer??s
|
SBP
|
M199
|
DMEM
|
|
Mg
|
⊗
|
|
|
??
|
??
|
T
|
|
|
|
⊗
|
|
Mg-Ca
|
??
|
|
|
|
|
|
|
|
|
|
|
AZ31
|
|
|
|
??
|
|
|
|
|
|
|
|
AZ80
|
|
|
|
|
|
⊗
|
|
|
|
|
|
AZ91
|
|
|
|
|
??
|
??
|
|
|
|
|
|
M1A
|
|
|
|
|
|
T
|
|
|
|
|
|
LAE442
|
|
|
|
??
|
|
|
|
|
|
|
|
ZK21-0.2Sc
|
|
|
|
|
??
|
|
|
|
|
|
|
Mg-Nd-Zn-Zr
|
|
|
|
|
|
|
|
|
??
|
|
|
WE43
|
|
|
|
|
|
|
|
|
|
??
|
|
MgY
|
|
|
|
|
|
|
|
|
|
??
|
|
Mg-Zn-Zr
|
|
|
|
|
|
|
|
|
|
??
|
|
Zn
|
|
|
|
|
|
|
|
??
|
|
|
|
316L stainless steel
|
??
|
|
??
|
⊗
|
|
|
??
|
|
|
|
|
Low carbon austenite
stainless steel
|
|
|
|
??
|
|
|
|
|
|
|
|
430/304
stainless steel
|
|
|
|
??
|
|
|
|
|
|
|
|
Ti
|
??
|
??
|
|
○
|
|
|
??
|
|
|
|
|
Ti-6Al-4V
|
○
|
??
|
??
|
⊗
|
|
|
|
??
|
|
|
|
CoCrMo
|
??
|
|
|
⊗
|
|
|
|
|
|
|
|
Nb
|
|
|
|
T
|
|
|
|
|
|
|
|
Zr
|
|
|
|
T
|
|
|
|
|
|
|
Note: The symbols indicate the different effects of BSA on the corrosion rate: ?? means “increase”, ○ means “no effect”, ?? means “decrease”, ⊗ means that BSA has different effects in different experiments, T means “BSA decreases the corrosion rate in short time and then increases the corrosion with the time prolonged”
新窗口打开| 下载CSV
2.3 蛋白质存在时金属材料的腐蚀机理
综上所述,体外测试中,蛋白质会对医用金属材料的腐蚀行为产生不同的影响,并且与多种因素有关,如金属材料的成分[64]、蛋白质的浓度与种类[11,35,42]、测试时间[15,27,85]、测试方法的选择[56,58]等。各种因素的差异也导致了蛋白质对腐蚀的影响没有一致的结果。但是目前,研究者一致认为蛋白质改变金属材料腐蚀行为的机理主要是吸附与螯合:蛋白质吸附在材料表面后形成的分子层有一定的屏障作用,可以阻碍界面的物质传输,增加电荷转移电阻[68];与Cl-等腐蚀性离子比较,带负电的蛋白质可更牢固地吸附在材料表面,占据O2的反应位点,或阻碍O2传输,从而抑制阴极反应[86];但是表面缺氧又会导致氧化物致密性降低,腐蚀性离子会穿过膜层中的孔洞到达基体表面,加快金属溶解。此过程中,金属离子与蛋白质之间的螯合作用可能会促进离子溶解,导致腐蚀加快[87]。
Khan等[55]以Ti-6Al-4V、Ti-6Al-7Nb和Ti-13Nb-13Zr 3种钛合金为例,解释了BSA吸附与金属腐蚀的关系。如图9[55]所示,初始阶段,带负电荷的BSA难以吸附在氧化膜表面,随着Cl- (或真实环境中的机械摩擦)对氧化膜的破坏,溶解的金属离子与BSA结合,形成的复合物脱离表面进入溶液,加速腐蚀;如果沉积在材料表面,就会提高其耐蚀性能。对钛合金而言,BSA形成的复合物沉积在表面后降低了氧化层的硬度,但提高了材料在PBS中的耐蚀性能。根据模型推测,蛋白质与金属的结合方式有2种:一种是裸金属与蛋白质之间的结合。骨或牙植入体受到机械摩擦时,裸露的金属表面与蛋白质接触,这时金属离子与蛋白质的结合相对较快;另一种情况是金属氧化物与蛋白质的结合。静态下,金属材料表面存在氧化物,当蛋白质-金属之间的结合键强于金属-氧之间的结合键时,蛋白质可与金属连接(过程缓慢)。金属氧化物之间的化学键被减弱,蛋白质-金属复合物可能会脱离表面(过程更慢)[88,89],从而加速腐蚀。但是这种情况的发生需要有较强的驱动力,比如高浓度的蛋白质、搅拌、高离子强度,或通过Vroman效应——小分子蛋白质先吸附在材料表面,之后被大分子蛋白质取代[90]。对于可降解金属材料——镁合金,在研究中发现了类似的腐蚀机理[79]。镁合金接触溶液时,H+和OH-优先到达表面生成Mg(OH)2。Cl-攻击氧化层导致Mg2+溶解,然后吸引溶液中带负电的BSA。BSA与Mg2+的结合又会加速其溶解。
图9
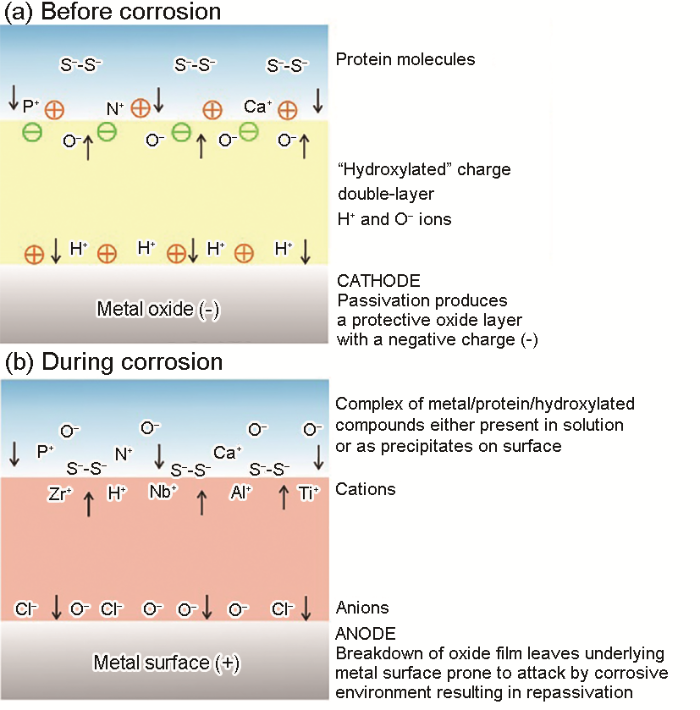
图9 BSA吸附过程中,钛合金/液体界面之间电荷转移的理论模型[55]
Fig.9 Theoretical model of charged double layer showing the transfer of charge at the metal/oxide/protein interfaces before (a) and during (b) the corrosion process[55]
3 结语
蛋白质在医用金属材料表面的吸附以及对腐蚀行为的影响存在很多不确定性。蛋白质的吸附是一个动态过程,但是目前,缺乏理想的实时监测手段观察蛋白质如何从溶液到达金属表面、吸附、再脱离表面,以及此过程中分子构型的变化、分子之间的聚集或是与其他离子的结合等。大部分的研究结论都是基于对吸附前后材料表面的分析或对电化学测试结果的推理,而缺乏可靠的实验证据。因此,只能间接推断蛋白质的吸附机理,而缺乏在分子水平上的数据验证。分子动力学模拟为这种表征提供了可能,但是模拟过程也会受到多种条件的限制,只能研究一种蛋白质在固体表面的吸附,无法考虑蛋白质浓度的影响以及其他有机分子及离子存在时对吸附的影响。
对于蛋白质对金属材料腐蚀过程的影响,目前缺乏理想的体外测试标准,尤其是可降解金属材料,之前的测试标准(针对惰性金属材料)或许已经不再适用。首先,目前常用的模拟体液中无机盐成分本来就存在成分和含量上的差异,溶液中离子强度的不同会影响蛋白质与金属材料表面的相互作用,进而影响材料的腐蚀行为。因此,在现有的模拟体液中加入蛋白质可能会造成更多实验结果上的差异。其次,缺少对金属表面反应的实时监测。比如,蛋白质吸附在金属表面后,氧化膜的破坏与生成、蛋白质如何参与到腐蚀产物中、腐蚀产物的生成与溶解等,都缺少直接的检测方法。另外,现有的体外测试中使用的蛋白质主要以BSA为主,而在人体内的不同位置,蛋白质的种类以及浓度并不相同。比如,血液中蛋白质的浓度要高于组织液,而在血浆中就包含血清蛋白、血红蛋白等多种蛋白质。因此,需要根据植入材料的目标位置选择蛋白质的种类以及浓度。多种蛋白质及其他有机分子同时存在时,还需要考虑金属表面是否会受到蛋白质与其他分子之间相互作用的影响。此外,不同功能的医用金属材料在体内也会受流体和机械载荷的影响,如骨植入体承受人体活动时产生的摩擦、股骨支架承受循环弯曲载荷,心血管支架会受到血液冲刷、血管壁的循环张力负荷;牙种植体则需要考虑口腔内咀嚼时的载荷等。但是在目前的体外测试中,对材料腐蚀性能的评价主要以静态浸泡和电化学测试为主,缺少对人体内动态环境以及负载的模拟。最后,对比图1和表6可以发现,现有的测试数据中,大部分镁合金的体外降解速率高于体内降解速率;而在体外测试中加入蛋白质后,材料的腐蚀速率可能会进一步加快,导致体内外测试的数据差异更大。这说明蛋白质可能不是影响金属材料腐蚀的唯一因素,现有的体外测试方法仍需进一步改善。
理想的体外测试结果有助于对金属材料的体内腐蚀行为做出合理的预测。因此,体外测试的设计要接近体内真实环境。具有相同功能的植入材料,可使用相同的模拟体液(含蛋白质),以减小不同实验室之间的差异,获得更具说服力的结果。另外,可灵活设置体外模拟体液中的成分及其含量,便于研究某些成分对金属材料腐蚀过程的影响,了解材料的腐蚀机理,或对材料的耐蚀性能进行初步的评价、对比和筛选。另外,可尝试使用荧光显微镜观察蛋白质在金属表面的吸附与分布情况,利用原子力显微镜-电化学装置观察蛋白质吸附时金属材料的腐蚀情况。在生物体内,细胞、组织等的新陈代谢与金属材料的降解之间也可能会存在相互作用,但是在体外模拟这些生理环境存在一定的难度。因此,对医用金属材料的体内测试仍是不可忽略的部分。当体内外测试的数据足够多时,对比金属材料体内外腐蚀速率的差异,并找出相关的影响因素,从而建立体内外腐蚀速率之间的关系公式。这将为预测金属材料在体内的腐蚀速率提供可靠、有效的依据。
综上所述,体外测试作为对医用金属材料腐蚀性能的初步评价方式,有必要考虑溶液中的蛋白质在材料表面的吸附及其对腐蚀行为的影响,以减少体内外测试结果的差异,更加合理地预测医用金属材料在体内的腐蚀行为。
















 沪公网安备31011202020290号
沪公网安备31011202020290号
